微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将一定量A、B装入容积为1 L的恒温密闭容器中,发生反应:2A(g)+bB(g)  cC(g),1 min时达到平衡,C的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的
cC(g),1 min时达到平衡,C的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的 ,重新达到平衡后,C的浓度为2.5 x mol·L-1,下列说法正确的是? ( )
,重新达到平衡后,C的浓度为2.5 x mol·L-1,下列说法正确的是? ( )
A.化学计量数的关系:b<c
B.容器的容积减小后,该反应的逆反应速率减小
C.原容器中用B的浓度变化表示该反应在1 min内的速率为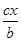 mol·(L·min)-1
mol·(L·min)-1
D.若保持温度和容器的容积不变,充入氦气(不参与反应),平衡不发生移动
参考答案:D
本题解析:由题意可知,压强增大,平衡向正反应方向移动,所以b+2>c,但得不出b和c的相对大小关系,A项错;容器的容积减小后,正、逆反应速率都增大,B项错;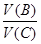 =
=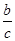 ,v(B)=
,v(B)=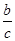 ·v(C)=
·v(C)=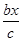 ?mol·(L·min)-1,C项错。
?mol·(L·min)-1,C项错。
本题难度:一般
2、填空题 面对全球近期的气候异常,环境问题再次成为焦点。化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)等气体已成为大气污染的主要因素。
(1)CO中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应方程式可表示为:
CO+HbO2 O2+HbCO 实验表明,c(HbCO)即使只有c(HbO2)的1/50,也可造成人的智力损伤。已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol/L,若使c(HbCO)小于c(HbO2)的1/50,则吸入肺部CO的浓度不能超过________mol/L。
O2+HbCO 实验表明,c(HbCO)即使只有c(HbO2)的1/50,也可造成人的智力损伤。已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol/L,若使c(HbCO)小于c(HbO2)的1/50,则吸入肺部CO的浓度不能超过________mol/L。
(2)汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”。已知反应
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-113 kJ/mol
N2(g)+2CO2(g) ΔH=-113 kJ/mol
①实验发现该反应在100℃~400℃的温度范围内,温度每升高10℃,反应速率却约为原来的3倍,在400℃~450℃时,温度每升高10℃,反应速率却约为原来的10倍,而温度高于450℃时,温度每升高10℃,反应速率又约为原来的3倍。若其他反应条件不变,试分析造成这种现象的可能原因是____________________。
②为了模拟催化转化器的工作原理,在T℃时,将2 mol NO与1 mol CO充入1 L反应容器中,反应过程中
NO(g)、CO(g)、N2(g)的物质的量浓度变化如图所示,则反应进行到15 min时,NO的平均反应速率为_______________。
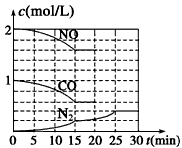
③写出该反应的化学平衡常数表达式K=__________;如温度升高时,K值______(填“增大”、“减小”或“不变”,下同),增大压强时,K值________________。
④请在图中画出20~30 min内NO、CO浓度发生变化的曲线,引起该变化的条件可能是______(填字母)。
a.加入催化剂 b.降低温度 c.缩小容器体积 d.增加CO2的物质的量
⑤当25 min达到平衡后,若保持体系温度、容积不变,再向容器中充入NO、N2气体各1 mol,平衡将________移动(填“向左”、“向右”或“不”)。
参考答案:(1)1.0×10-6
(2)①催化剂在400℃~450℃活性最大;②0.4/15 mol/(L·min)[或0.027 mol/(L·min)];
③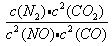 ;减小;不变;④
;减小;不变;④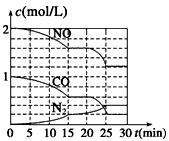 ;“略”⑤向左
;“略”⑤向左
本题解析:
本题难度:一般
3、填空题 化学学科中的平衡理论主要包括:化学平衡、电离平衡和水解平衡三种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ、在恒容密闭容器中,发生反应3A(g)+B(g) 2C(g) ΔH=Q kJ/mol。回答下列问题:
2C(g) ΔH=Q kJ/mol。回答下列问题:
(1)写出该反应平衡常数的表达式__________。
(2)下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号)。
① v(A)=3v(B)?②混合气体的密度保持不变
③有3 mol A消耗的同时有1 mol B生成 ④C的浓度保持不变
(3)根据实验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q______0(填“大于”或“小于”)。
Ⅱ、(1)室温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填 “a”或“b”)。设盐酸中加入Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1________m2(选填“<”、“=”或“>”)。
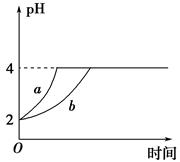
(2)若室温下pH=2的盐酸和醋酸溶液各 100 mL,分别加水稀释后使pH=4,设盐酸中加入水的体积为V1,醋酸溶液中加入的水的体积为V2,则 V1______V2(填“<”“=”或“>”)。
Ⅲ、常温下,浓度均为0.1 mol/L 的下列六种溶液的pH如下表:
溶质
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
| NaCN
| C6H5ONa
|
pH
| 8.8
| 9.7
| 11.6
| 10.3
| 11.1
| 11.3
|
(1)上述盐溶液中的阴离子,结合H+能力最强的是?
(2)根据表中数据判断,浓度均为0.01 mol/L 的下列五种物质的溶液中,酸性最强的是_______ (填编号) ; 将各溶液分别稀释100倍, pH变化最小的是??(填编号) 。
A.HCN? B.HClO? C.C6H5OH? D.CH3COOH? E.H2CO3
(3)据上表数据,请你判断下列反应不能成立的是 ?(填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2C6H5 ONa=Na2CO3+2C6H5OH
Ⅳ、已知:ZnCl2·xH2O易溶于水,且其浓的水溶液呈较强酸性;SOCl2 (氯化亚砜)极易和水发生如下反应:SOCl2+H2O=SO2+2HCl。实验室中制取无水氯化锌采用ZnCl2·xH2O与SOCl2混合加热的方法。试回答:
SOCl2的作用是___________________________________。
参考答案:Ⅰ.⑴K=c2(C)/c3(B)c(A)⑵ ③④ ⑶大于。
Ⅱ.(1)?b ,?<?。(2)?<?。
Ⅲ.①?CO32 -?,②?D?,?C?。 ③?C 。
Ⅳ?夺去ZnCl2·xH2O中的水,同时生成HCl,它可以抑制ZnCl2的水解?。
本题解析:Ⅰ.⑴反应3A(g)+B(g) 2C(g)的平衡表达式为K=c2(C)/c3(B)c(A);
2C(g)的平衡表达式为K=c2(C)/c3(B)c(A);
(2)当该反应达到平衡时, v(A)=3v(B)不能作为其标志,因为整个过程都是v(A)=3v(B),混合气体的密度保持不变,不能作为其达到平衡的标志,因为整个过程中混合气体的密度保持不变;有3 mol A消耗的同时有1 mol B生成和C的浓度保持不变可以作为判断其达到平衡的标志,所以本题的答案为③④;
(3)温度越高该反应的化学平衡常数越大,根据勒夏特勒原理,可以知道该反应为吸热反应,所以Q大于0;
Ⅱ(1)pH=2的盐酸和醋酸,相同体积的条件下,醋酸的物质的量远远大于盐酸的物质的量,但当两者与锌反应时,由于醋酸不断电离出氢离子,所以比较慢达到pH=4,所以图中表示醋酸溶液中pH变化曲线的是b,且醋酸消耗的锌的质量较大;
(2)pH=2的盐酸和醋酸,相同体积的条件下,醋酸的物质的量远远大于盐酸的物质的量,所以加水稀释后使pH=4,醋酸所用水的体积较大;
Ⅲ(1)上述盐溶液中的阴离子,pH越大则说明结合H+的能力越大,所以结合H+能力最强的是CO32 - ;盐溶液中的阴离子,pH越小,说明其酸性越强,所以CH3COOH 的酸性最强;苯酚在水中的溶解度很小,所以将各溶液分别稀释100倍, pH变化最小的是苯酚;(3)根据强酸制备弱酸的原理,可以知道CO2+H2O+2C6H5 ONa=Na2CO3+2C6H5OH不能够成立,因为碳酸根的酸性比苯酚弱,故产物不能出现Na2CO3,所以答案选择C;
Ⅳ因为SOCl2 (氯化亚砜)极易和水发生如下反应:SOCl2+H2O=SO2+2HCl,产生的HCl有利于抑制锌离子的水解,且可以抢夺ZnCl2·xH2O中的水,即SOCl2的作用是夺去ZnCl2·xH2O中的水,同时生成HCl,它可以抑制ZnCl2的水解。
点评:本题综合考查了化学平衡、强弱电解质、盐类水解的相关知识,该题综合性强,涉及的范围比较广,该题有一定的难度。
本题难度:一般
4、选择题 在一定条件下,将1 mol CO和1 mol水蒸气通入容器中发生下述反应:CO+H2O CO2+H2,达到平衡后,测得CO2 0.6 mol;再通入0.3 mol水蒸气,又达到平衡后,CO2的物质的量为
CO2+H2,达到平衡后,测得CO2 0.6 mol;再通入0.3 mol水蒸气,又达到平衡后,CO2的物质的量为
A.0.7mol
B.0.8mol
C.0.6mol
D.0.9mol
参考答案:A
本题解析:第一次平衡后再通入0.3 mol水蒸气平衡向右移动,达新平衡时二氧化碳的物质的量一定大于0.6摩尔,故排除答案C;依平衡移动原理0.3 mol水蒸气不会全部转化为二氧化碳及氢气,从而排除答案D;又依平衡移动原理知新平衡下的反应物转化率一定小于前次平衡的转化率,而第一次平衡时水蒸气的转化率为百分之六十,按此计算0.3*60/100=1.8摩尔,0.6+1.8=7.8摩尔,而达新平衡时二氧化碳的物质的量应小于7.8摩尔,排除B,而选A。
本题难度:一般
5、填空题 化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
某温度反应(Ⅰ)的K=4,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为? ?。
(2)如下图所示,反应(Ⅰ)在石英真空管中进行,先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,则该正反应的△H?0(填“>”或“<”),上述反应体系中循环使用的物质是?。
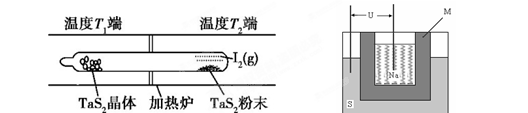
(3)上图为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na + xS=Na2Sx,正极的电极反应式为____________________________。M(由Na2O和Al2O3制得)的两个作用是________________________________________________和隔离钠与硫。
(4)写出Na2S溶液水解的离子方程式_______________________________________,Na2S溶液中c(H+)+ c(Na+)=________________。
参考答案:(1)80%(2分)(2)>(1分); I2(2分)(3)xS+2e-=Sx2-(2分);离子导电(2分)
(4)S2-+H2O HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O H2S+OH-(2分,只写第一步也可得分)
H2S+OH-(2分,只写第一步也可得分)
c(HS-)+2c(S2-)+c(OH-) (2分)
本题解析:(1)? TaS2(s)+2I2(g) TaI4(g)+S2(g)
TaI4(g)+S2(g)
起始量(mol)? 1? 0? 0
转化量(mol)? 2x? x? x
平衡量(mol)? 1-2x? x? x
由于反应前后体积不变,因此可以用物质的量代替物质的量浓度表示其平衡常数,即
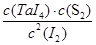 =4=
=4=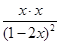
解得x=0.4
所以I2(g)的平衡转化率为 ×100%=80%
×100%=80%
(2)加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,这说明低温有利于TaS2晶体的生成,因此逆反应是放热反应,则正方应是吸热反应,即△H>0;先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),而最后又产生单质碘,因此单质碘是可以循环的物质。
(3)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据方程式2Na + xS=Na2Sx可知,钠是还原剂,做负极,S单质是氧化剂,在正极得到电子,因此正极反应式为xS+2e-=Sx2-。在熔融状态下,Na2O和Al2O3能电离出阴阳离子而使电解质导电,因此另外一种作用是离子导电。
(4)硫化钠是强碱弱酸盐,S2-水解溶液显碱性,因此Na2S溶液水解的离子方程式为S2-+H2O HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O H2S+OH-;根据电荷守恒可知Na2S溶液中c(H+)+ c(Na+)=c(HS-)+2c(S2-)+c(OH-)。
H2S+OH-;根据电荷守恒可知Na2S溶液中c(H+)+ c(Na+)=c(HS-)+2c(S2-)+c(OH-)。
本题难度:一般