微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于反应A(g)+3B(g) 2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
[? ]
A.v(A)=0.01 mol/(L·s)
B.v(B)=0.02 mol/(L·s)
C.v(B)=0.60mol/(L·min)
D.v(C)=1.0mol/(L·min)
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列关于化学平衡常数(K),电离平衡常数(Ka或Kb),水解平衡常数(Kh),沉淀溶解平衡常数(Ksp),水的离子积常数(Kw)的叙述中错误的是
A.K值越大,正反应进行的程度越大,一般地说,K>105时,该反应进行得就基本完全了
B.比较Ksp与离子积Qc的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解
C.K、Ka或Kb、Kh、Ksp、Kw都与温度有关,温度越高,常数值越大
D.弱酸HA的Ka与NaA的Kh、水的离子积常数Kw三者间的关系可表示为:Kw=Ka ·Kh
参考答案:C
本题解析:A、相同条件下不同反应的K值越大,表示反应进行的程度越大;相同的化学反应在不同条件下,K值越大,表示反应进行的程度越大,故A正确;B、比较Ksp与离子积Qc的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解,Qc>Ksp时?,溶液过饱和有沉淀析出;Qc=Ks时,溶液饱和,沉淀与溶解处于平衡状态;Qc<Ksp时,溶液不饱和无沉淀析出,故B正确;C、平衡常数都是温度的函数,随温度变化做相应的变化,电离平衡常数、水的离子积常数和溶解平衡常数温度升高其值都增大,但是化学平衡常数随温度的变化和反应的吸放热情况有关,故C错误;水解和电离为可逆过程,Ka=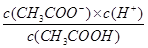 ,Kb=
,Kb=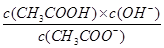 ;则有Ka?Kh=Kw,故D正确。
;则有Ka?Kh=Kw,故D正确。
本题难度:一般
3、选择题 对于可逆反应mA(g)十nB(g) pC(g)十qD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到如下两种v-t图象。下列判断正确的是(?)
pC(g)十qD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到如下两种v-t图象。下列判断正确的是(?)
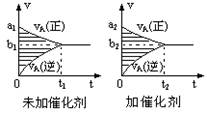
A.b1>b2 t1>t2
B.b1<b2t1<t2
C.两图中阴影部分面积相等
D.图II中阴影部分面积更大
参考答案:C
本题解析:由图象可知,加入催化剂,反应速率增大,但催化剂只影响反应速率,不影响平衡移动,以此解答该题.加入催化剂的结果一是正、逆反应速率都增大,二是缩短了达到平衡的时间。由此可得:a1<a2、b1<b2、t1>t2,但不使平衡移动推知,阴影面积为反应物浓度的变化,由于催化剂不影响平衡移动,则两图中阴影部分面积相等。故选C。
点评:考查了催化剂对化学反应速率和平衡移动的影响,以图象题题目的形成考查,题目难度不大,注意分析图象的涵义。
本题难度:简单
4、实验题 在一定温度下,把2 mol N2和6 mol H2通入一个体积不变的密闭容器中,(如右图):容器中发生以下的反应:
N2(g)+3 H2(g) 2NH3 (g)?(正反应为放热反应)
2NH3 (g)?(正反应为放热反应)
若反应达到平衡后,测得混和气体为7 mol ,据此回答下列问题:
保持上述反应温度不变,使a、b、c分别代表初始加入的N2、H2和NH3的物质的量,如果反应达到平衡后混和气体中各物质的物质的量分数仍与上述平衡时完全相同,那么:
(1)若a="1" mol ,c="2" mol ,则b="____" mol,在此情况下,反应起始时将向?方向进行(填 “正”或“逆”)
(2)若规定起始时反应向逆反应方向进行,则c的范围是?。
(3)在上述装置中,若需控制平衡后的混和气体的物质的量为6.5 mol,则可采取的措施是?
参考答案:1)b="__3____" mol,? __逆反应__?方向进行(2)? 1<c≤4? ___?。
(3)措施是?降低温度
本题解析:略
本题难度:简单
5、选择题 一定温度下,固定体积的容器中充入1molSO2和1molO2,再加入少量的NO,在体系中发生①2NO+O2=2NO2;②SO2+NO2=SO3+NO,下列说法错误的是
A.体系中的总反应是:2SO2+ O2 2SO3
2SO3
B.在反应过程中NO是催化剂
C.NO参与反应历程,降低反应活化能,加快反应速率
D.NO的引入可以增加SO2的平衡转化率
参考答案:D
本题解析:略
本题难度:简单