微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氨的喷泉实验体现了氨的那些性质
A.还原性
B.极易溶于水
C.具有刺激性气味道
D.氧化性
参考答案:B
本题解析:
正确答案:B
氨气极易溶于水,烧瓶内的压强急剧减小,内外形成压强差,形成喷泉。
本题难度:一般
2、计算题 (8分)海水中溴常以NaBr形式存在,从海水中提取溴的方法之一是:①通入Cl2至浓缩的溴化物溶液,氧化海水中的Br-,然后用空气把生成的溴吹出。②以氢氧化钠溶液吸收Br2(Br2跟烧碱生成NaBr和NaBrO3)。③向所得含溴化合物溶液中加稀H2SO4,溴又重新析出。完成下列问题:
(1)写出各步反应的化学方程式。(提示:第③步反应中生成物有硫酸钠)
(2)经分析海水中含溴0.006 5%,则海水中含NaBr的质量分数是多少?试计算多少吨海水可制得1.0 t溴?(假设提取过程中溴无损失)
参考答案:
(1)2NaBr+Cl2====2NaCl+Br2;6NaOH+3Br2====5NaBr+NaBrO3+3H2O;5NaBr+NaBrO3 +3H2SO4====3Na2SO4+3Br2+3H2O
(2)0.008 4%?需海水的质量为15 384.6 t
本题解析:因海水中含溴0.006 5%,则海水中含NaBr的质量分数为0.006 5%×(103/80)="0.008" 4%;设需x t海水,则:0.006 5%x t="1" t,解得:x="15" 384.6 t。
本题难度:简单
3、实验题 右图为实验室某浓盐酸试剂瓶上的标签,试 根据有关数据回答下列问题:
根据有关数据回答下列问题:
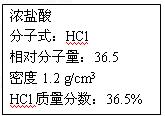
(1)该浓盐酸中HCl的物质的量浓度为?mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是?。
A.溶液中HCl的物质的量? B.溶液的浓度
C.溶液中Cl-的数目? ?D.溶液的密度
?D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.30 mol/L稀盐酸。
①该学生需要量取?mL上述浓盐酸进行配制。
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) ??。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,轻轻摇动容量瓶
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30 mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500 mL的容量瓶中
D.将容量瓶的玻璃塞盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2 cm处
③在配制过程中,下列操作会使所配制的稀盐酸物质的量浓度偏高的是?。
A.用量筒量取浓盐酸时俯视观察凹液面
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配置前用已知浓度的稀盐酸润洗容量瓶
(4)现将200 mL 0.30 mol/L的盐酸与50 mL 0.80 mol/L CaCl2溶液混合(体积变化忽略不计),所得溶液中Cl-的物质的量浓度是? mol/L;向所得混合溶液中加入5.3 g Na2CO3固体,充分反应后,溶液中生成沉淀的质量有_________g。
(5 )在标准状况下,将______________L HCl气体溶于1000 mL水中(水的密度为1 g/cm3),所得盐酸的密度为1.2 g/cm3,溶质质量分数为36.5% 。(保留小数点后一位)
参考答案:(1)12(2分)
(2)B D(2分)
(3)①12.5(2分)
②B C A F E D(2分)
③B D(2分)
(4)0.56(2分)? 2.0 (2分)
(5)352.8(2分)
本题解析:略
本题难度:简单
4、选择题 已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O、如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好、下列描述正确的是
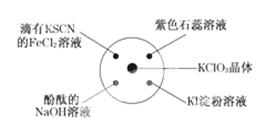
A.淀粉KI溶液中变蓝,说明Cl2具有氧化性
B.滴有酚酞的NaOH溶液褪色,说明Cl2具有酸性
C.石蕊溶液先变红后褪色,说明Cl2具有漂白性
D.滴有KSCN的FeCl2溶液变红,说明Cl2具有还原性
参考答案:A
本题解析:
解决本题学生要熟记相关反应方程式。
仔细读题不难看出隐含条件:有水
A:Cl2 + 2KI =" 2KCl" + I2生成物I2和淀粉作用显蓝。正确。
B:Cl2+2NaOH=NaCl+NaClO+H2O 发生反应而褪色。
C:Cl2 + H2O =" HCl" + HClO 生成了HClO具有漂白性。
D:Cl2 + 2Fe2+ = 2Cl- + 2Fe3+体现Cl2的强氧化性。
本题难度:一般
5、实验题 某化学兴趣小组为了探究某些气体的性质,设计了如图所示的实验装置。实验时将A、D中产生的气体同时通入C中。(K为止水夹,部分夹持仪器已略去)
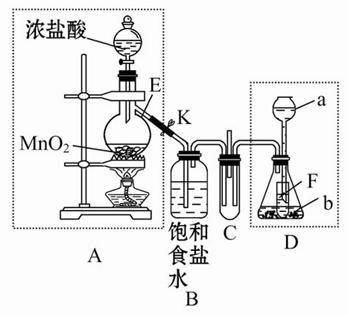
回答下列问题:
(1)简述实验前检查A部分装置气密性的方法_______________________________________。
(2)仪器E的名称是______,锥形瓶内小试管F的作用是______。
(3)若b是生石灰,a是______时,在C中有白烟产生,写出生成白烟的化学方程式________________________。
(4)若a是质量分数为75%的硫酸,b是亚硫酸钠粉末,在C中盛适量的BaCl2溶液时,写出C中发生反应的离子方程式:____________。
(5)从环保的角度出发,上述实验装置中需要改进的是____________________________________________。
参考答案:(1)关闭止水夹K,打开分液漏斗活塞,经分液漏斗向蒸馏烧瓶中加水,稍后若水不能加入,说明A的气密性良好(或向B中加适量水,将A的导管出口浸入水中,关闭分液漏斗活塞,用酒精灯或手给蒸馏烧瓶微热,若B中导管出口有气泡逸出,熄灭酒精灯或松开手后,导管内有高出液面的水柱,一段时间不下降,说明气密性良好)
(2)蒸馏烧瓶?减少液体用量并形成液封,防止气体逸出
(3)浓氨水? 3Cl2+8NH3=6NH4Cl+N2(分步写化学方程式也可)
(4)Cl2+SO2+Ba2++2H2O=2Cl-+BaSO4↓+4H+ (分步写离子方程式也可)
(5)在C管口外接尾气处理装置,防止污染空气
本题解析:该实验是考查气体制取和探究气体性质的实验。A中生成的是Cl2,D中锥形瓶中加一小试管可以减少液体的用量,同时对长颈漏斗形成液封。若D中用生石灰和浓氨水作用会生成NH3,NH3与Cl2在C中发生反应生成NH4Cl,产生白烟;若D中用浓硫酸和Na2SO3固体粉末反应,生成SO2,在C中Cl2、SO2、BaCl2溶液发生反应,有BaSO4生成。该装置缺少尾气处理装置,会对空气产生污染。
本题难度:一般