微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
①?将白色粉末加水溶解,得无色溶液。
②?向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向
滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B。
根据上述现象判断:
A的化学式是??B的化学式是?
(2)原白色粉末中一定含有?,可能含有?,
对可能含有的物质,可通过?(填实验名称)进一步检验。
参考答案:((1)BaCO3? AgCl?(2)NaHCO3、BaCl2? KCl?焰色
本题解析:白色粉末加水后,溶解且得无色溶液,则其中必不含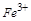 ,即不含
,即不含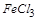 ;
;
溶液中加入NaOH溶液,观察到有白色沉淀A生成,表明其中含有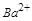 ,即含有
,即含有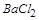 ;因为
;因为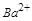 与
与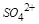 不能共存,所以其中不含
不能共存,所以其中不含 ,故白色沉淀
,故白色沉淀 为
为 ;
;
滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B,表明其中含有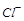 ,白色深沉
,白色深沉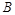 为
为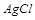 .
.
上述的实验无法证实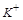 的存在与否,因而
的存在与否,因而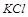 是否存在无法确定.要想确定其是否存在,通过焰色反应来完成,
是否存在无法确定.要想确定其是否存在,通过焰色反应来完成,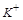 的在焰色反应中显示紫色。
的在焰色反应中显示紫色。
综上有白色沉淀 为
为 ,
,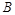 为
为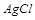 ,
,
原白色粉末中一定含有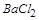 ,可能含有的物质为
,可能含有的物质为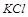 ;鉴定的存在用焰色反应.
;鉴定的存在用焰色反应.
本题难度:简单
2、简答题 图中A~H均为中学化学中常见的物质,A、B、H是气体,E是一种白色沉淀,它们之间有如下转化关系.(反应中生成的水已略去)

请回答以下问题:
(1)A是______,C是______,H是______.(填化学式)
(2)干燥的D物质在实验室中常用作______剂.
(3)写出少量B与C反应④的化学方程式:______.
参考答案:B可与澄清石灰水反应生成沉淀,应为CO2,则E为CaCO3,常见能与石灰水反应的气体还有氯气,则A应为Cl2,由此可知C为Ca(ClO)2,F为HCl,D为CaCl2,G为HClO,H为O2,
(1)由以上分析可知A为Cl2,C为Ca(ClO)2,H为O2,故答案为:Cl2;Ca(ClO)2;O2;
(2)D为CaCl2,具有吸水性,可作干燥剂,故答案为:干燥;
(3)少量B与C反应④的化学方程式为CO2+H2O+Ca(ClO)2=2HClO+CaCO3↓,故答案为:CO2+H2O+Ca(ClO)2=2HClO+CaCO3↓.
本题解析:
本题难度:一般
3、简答题 现有常见金属单质A、B、C和常见气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).
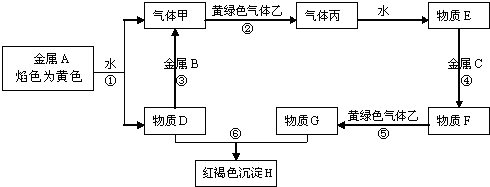
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A______;丙______
(2)写出反应②的化学方程式______
(3)写出下列反应离子方程式:
反应③______
反应⑤______
反应⑥______.
参考答案:金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl金属C
本题解析:
本题难度:简单
4、填空题 (11分)现有四瓶贴有A、B、C、D标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液。现进行如下实验,并记录部分现象(如下图):
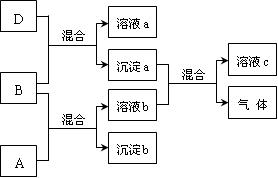
据此完成下列回答:
(1)写出各物质的化学式
A、??B、??C、??D、?
(2)写出下 列反应的离子方程式:
A + B反应:?
沉淀a+溶液b:?
(3)检验物质D中阴离子的方法为?
?(说明实验操作、现象与结论等)。
参考答案:(1)NaHSO4、Ba(NO3)2、K2SO4、K2CO3
(2)Ba2++SO42-=BaSO4↓、BaCO3+2H+=Ba2++CO2↑+H2O
(3)向D中加入足量的稀盐酸,将产生的无色无味的气体通入澄清的石灰水中,可以看到石灰水变浑浊,即证明D中含有CO32-。
本题解析:图中生成的沉淀a和b只能是BaCO3和BaSO4,由于沉淀a能和溶液b反应,则沉淀a是BaCO3,溶液b中含有H+。据此可以确定B、D、A、C分别为Ba(NO3)2、K2CO3、NaHSO4、K2SO4。据此可以书写离子方程式。可以利用盐酸和澄清的石灰水检验CO32-的存在。
本题难度:简单
5、填空题 已知A~F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子.反应中部分生成物已略去.

试回答下列问题:
(1)根据图中信息,物质B、C、X氧化性从强到弱的顺序是______.(用化学式表示)
(2)B的电子式为______,它属于______晶体.
(3)写出反应②的化学方程式:______.
(4)写出反应①、⑥的离子方程式:
①______.
⑥______.
参考答案:已知A~F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志判断为H2SO4,A为SO2,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,判断反应是制备氯气的反应原理,X为MnO2,C为Cl2,F为HCl;B分子中有18个电子,和二氧化硫反应生成硫酸,说明B是氧化剂;推断B为H2O2,和MnO2反应,过氧化氢做还原剂生成氧气,E为O2;
(1)据图中信息,物质B为H2O2、C为SO2、X为MnO2,氧化性从强到弱的顺序依据反应关系,H2O2+SO2=H2SO4;
H2O2+MnO2+H2SO4=MnSO4+2H2O+O2↑;MnO2+4HCl=MnCl2+Cl2↑+2H2O,发生的氧化还原反应中氧化剂氧化性大于氧化产物得到:MnO2>Cl2>H2O2,
故答案为:MnO2>Cl2>H2O2;
(2)B为H2O2是共价化合物,电子式为
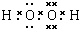
,属于分子晶体,故答案为:
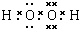
;分子;
(3)反应②的化学方程式是铜和浓硫酸反应生成硫酸铜、二氧化硫和水的反应,反应化学方程式为:Cu+2H2SO4(浓)?△?.?CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)?△?.?CuSO4+SO2↑+2H2O;
(4)反应①是氯气和二氧化硫在水溶液中发生的反应生成硫酸和盐酸,反应的离子方程式为:Cl2+SO2+2H2O═4H++SO22-+2Cl-;反应⑥是实验室制备氯气的反应,反应的离子方程式为:MnO2+4H++2Cl-?△?.?Mn2++Cl2↑+2H2O,
故答案为:Cl2+SO2+2H2O═4H++SO22-+2Cl-;MnO2+4H++2Cl-?△?.?Mn2++Cl2↑+2H2O.
本题解析:
本题难度:一般