微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列表示方法正确的是( )
A.NH4Br的电子式:
B.S2-核外电子排布式:[Ne] 3s23p6
C.O原子处于基态的轨道表示式:
D.用电子式表示MgCl2的形成: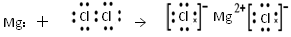
参考答案:B
本题解析:选项A不正确,应该是 ;选项C不正确,不符合洪特规则;选项D不正确,应该是
;选项C不正确,不符合洪特规则;选项D不正确,应该是 ,因此正确的答案选B。
,因此正确的答案选B。
本题难度:一般
2、填空题 (7分)金属钒(V)在材料科学上有重要作用,被称为“合金的维生素”。以下是测定矿石中钒的含量的两个反应:
(1)用稀硫酸溶解五氧化二钒,得到(VO2)2SO4溶液。写出该反应的化学方程式
____________________________________________________________;
该反应______(选填“是”或“不是”)氧化还原反应。
(2)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,完成下列离子方程式,方框内填数字,短线上填写物质的化学式或离子符号。
VO2+ + H2C2O4 + ______ → VO2+ + CO2 + ______
(3)当收集到标准状况下气体112毫升时,电子转移的数目为
(4)甲同学提出:上述反应能否用盐酸酸化?乙同学认为:要回答这个问题还得知道
A.VO2+ 和HCl氧化性相对强弱 B.VO2+ 和Cl2氧化性相对强弱 C.上述均不正确.
参考答案:(1)V2O5+H2SO4=(VO2)2 SO4+H2O 不是
(2)2、1、2H+、2、2、2 H2O
(3)0.005NA
(4)B
本题解析:(1)用稀硫酸溶解五氧化二钒,得到(VO2)2SO4溶液,化学方程式为V2O5+H2SO4=(VO2)2 SO4+H2O;该反应中的各元素的化合价在反应前后未发生变化,所以不是氧化还原反应;
(2)VO2+V的化合价是+5价,产物中V的化合价是+4价,H2C2O4中C的化合价是+3价,二氧化碳中C的化合价是+4价,所以C的化合价整体升高2价,根据氧化还原反应中得失电子守恒,VO2+、VO2+的系数是2,H2C2O4,的系数是1,二氧化碳的系数是2,根据电荷守恒,反应物中的电荷小于产物中的电荷数,所以反应物中的空白应是H+,产物中的空白应是H2O,H+的系数是2,则水的系数是2;
(3)标准状况下气体112毫升,物质的量是0.005mol,即生成0.005mol的二氧化碳,转移电子的物质的量是0.005mol,电子转移的数目为0.005NA
(4)若用盐酸酸化,则盐酸中的氯离子有还原性,所以能否用盐酸酸化,还需知道VO2+ 和Cl2氧化性相对强弱或VO2+与Cl-的还原性的相对强弱,若VO2+ 氧化性强,则不能用盐酸酸化,否则会生成氯气,不能氧化草酸,答案选B。
考点:考查化学方程式的书写,氧化还原反应的判断及配平、计算、氧化还原反应规律的应用
本题难度:一般
3、选择题 a mol FeS与b mol FeO投入到VL、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为①(a+b)×189g ②Vc-(9a+b) mol ③(a+b)mol ④Vc-(9a+b)/3mol
A.①④
B.②③
C.①③
D.②④