微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氯酸质量分数超过40%时会发生分解,反应可表示为:8 HClO3 =" 3" O2↑+ 2 Cl2↑+ 4 HClO4 + 2 H2O,下列说法正确的是
A.氧化性比较HClO4 > HClO3
B.氧化产物只有HClO4
C.氯酸分解后的混合气体平均相对分子质量为47.6
D.该反应转移电子数为12e—
参考答案:C
本题解析:氧化还原反应中,氧化剂的氧化性强于氧化产物的,所以选项A不正确;根据方程式可知,氯元素的化合价从+5价部分升高到+7价,部分降低到0价。而氧元素的化合价从-2价升高到0价,所以氧化产物有氧气和高氯酸,选项B不正确;根据氧气和氯气的体积之比是3︰2可知,混合气的平均相对分子质量是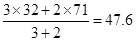 ,选项C正确;选项D不正确,转移电子的个数是20个,答案选C。
,选项C正确;选项D不正确,转移电子的个数是20个,答案选C。
本题难度:一般
2、选择题 二氧化硫是造成酸雨的主要成分之一,二氧化硫排放到空气中溶于水生成亚硫酸(H2SO3),其中亚硫酸中硫元素(S)的化合价为(? )
A.+2
B.-2
C.+4
D.+6
参考答案:C
本题解析:根据化合物中正负价代数和为0可知,亚硫酸中氢和氧化合价分别是+1价和-2价,所以硫的化合价是+4价。答案选C。
本题难度:简单
3、计算题 (9分)1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将17.4gMnO2与200g 36.5%的浓盐酸(过量)完全反应,把反应后所得溶液稀释到400mL。
MnCl2+Cl2↑+2H2O。现将17.4gMnO2与200g 36.5%的浓盐酸(过量)完全反应,把反应后所得溶液稀释到400mL。
(1)请用双线桥表示该反应电子转移方向和总数 _ __。MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)计算生成Cl2的体积(折算成标准状况)为__ ____L(写计算过程,否则不得分)。
(3)计算稀释后溶液中Cl—的物质的量浓度为__ ___ mol·L—1(写计算过程,否则不得分)。
参考答案:20.(9分)
(1)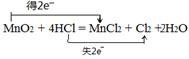 (2分) (2)4.48L (3分) (3)4 mol/L(4分)
(2分) (2)4.48L (3分) (3)4 mol/L(4分)
本题解析:(1)双线桥法表示电子转移, ;
;
(2)17.4gMnO2的物质的量为0.2mol,200g 36.5%的浓盐酸中HCl的物质的量为2mol,Cl-为2moL
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O 反应掉2Cl-
MnCl2+Cl2↑+2H2O 反应掉2Cl-
22.4 2
0.2 V n V=4.48L n=0.4moL
(3)稀释后溶液中Cl—的物质的量浓度为(2-0.4)/0.4=4 mol/L。
考点:考查氧化还原反应电子转移的表示方法,根据化学方程式计算。
本题难度:一般
4、选择题 下列褪色过程不是因为发生氧化还原反应而褪色的是
A.将氯水滴入到干燥的红布条上,红色布条褪色
B.将SO2气体通入品红溶液中,品红溶液褪色
C.将SO2气体通入酸性高锰酸钾溶液中,溶液褪色
D.向含有I2的淀粉溶液中加入KOH溶液,蓝色褪去
参考答案:B
本题解析:B、SO2与有色物质化合为无色物质,正确。
本题难度:一般
5、选择题 下列表示溶液中发生反应的化学方程式错误的是
[? ]
A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑
B.2KMnO4+HCOOK+KOH=2K2MnO4+CO2↑+H2O
C.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D.K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O
参考答案:B
本题解析:解析:
书写化学方程式要遵守下列原则:一是必须以客观事实为基础,绝不能凭空臆想、臆造事实上不存在的物质和化学反应;二是要遵守质量守恒定律,等号两边各原子种类与数目必须相等;三是对于氧化还原反应,要满足电荷守恒和电子守恒关系。由此判断A、C、D选项方程式书写正确,而B选项中反应在碱性环境下进行,不可能生成二氧化碳气体,故B错。
故选:B
本题难度:一般