微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4 (g)+4NO2 (g)="4NO" (g) +CO2 (g)+2H2O (g) △H=
参考答案:
本题解析:
本题难度:一般
2、填空题 短周期元素A、X、D、E、R、T原子序数依次增大,原子结构及性质如表所示:
元素
| 结构及性质
|
A
| A的原子半径最小
|
X
| X原子最外层电子数是次外层的两倍
|
D
| D是短周期中金属性最强的元素
|
E
| E的最高价氧化物对应水化物是一种常见的两性氢氧化物
|
R
| R与X同主族
|
T
| T的负一价阴离子的核外电子排布与Ar原子相同
|
(1)R元素在周期表的位置是 ,化合物DT中存在的化学键是 。
(2)写出E单质与NaOH溶液反应的离子方程式 。
(3)1g X2A4 完全燃烧,恢复到常温时放出a kJ的热量,写出X2A4完全燃烧的热化学方程式 。
(4)RT4极易水解生成两种酸,写出该反应的化学方程式 。
(5)已知某温度下T的某一元含氧酸的Ka = 4.0×10-8,若一定浓度该酸的pH=4,则此溶液的物质的量浓度为 。
参考答案:(1)第三周期Ⅳ族(1分) 离子键(1分)
(2)2Al+2OH?+2H2O = 2AlO2-+3H2↑ (2分)
(3)C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ?H=" -" 28a kJ?mol-1 (2分)
(4)SiCl4+3H2O =H2SiO3↓4HCl↑ (或SiCl4+4H2O 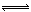 H4SiO4↓+4HCl↑)可以不标“↑”“↓”(2分)
H4SiO4↓+4HCl↑)可以不标“↑”“↓”(2分)
(5)0.25mol?L?1 (2分)
本题解析:A的原子半径最小,则A为H元素;X原子最外层电子数是次外层的两倍,则X为C元素;D是短周期中金属性最强的元素,则D为Na元素;E的最高价氧化物对应水化物是一种常见的两性氢氧化物,则E为Al元素;R与X同主族,则R为Si元素;T的负一价阴离子的核外电子排布与Ar原子相同,则T为Cl元素。
(1)R为Si元素,在元素周期表中位于第三周期Ⅳ族;化合物DT为NaCl,含有离子键。
(2)E为Al,与NaOH溶液反应的离子方程式为:2Al+2OH?+2H2O = 2AlO2-+3H2↑
(3)X2A4 为C2H4,1g C2H4完全燃烧,恢复到常温时放出a kJ的热量,则1mol C2H4即28g完全燃烧,恢复到常温时放出28a kJ的热量,可得热化学方程式:C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ?H=" -" 28a kJ?mol-1
(4)RT4为SiCl4,水解生成的两种酸为H2SiO3和HCl,或H4SiO4和HCl,所以水解方程式为:SiCl4+3H2O =H2SiO3↓4HCl↑ (或SiCl4+4H2O 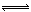 H4SiO4↓+4HCl↑)
H4SiO4↓+4HCl↑)
(5)该酸的pH=4,则该酸电离出的H+浓度为10-4mol?L?1,设该酸的物质的量浓度为C,根据电离平衡常数可得:Ka =10-4×10-4÷(c-10-4)= 4.0×10-8,解得c=0.25mol?L?1
考点:本题考查元素的推断、方程式的书写、化学键的判断、电离平衡常数的计算。
本题难度:困难
3、填空题 (14分)
(1)纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)= ;
若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)= 。
(2)在CH3COONa的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)明矾的水溶液显酸性,其原因是(用离子方程式表示) 。
(4)在25℃、101kPa下,0.5mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 。
(5)1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为 。
(6)已知:①N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol ;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4与NO2与完全反应生成氮气和气态水的热化学方程式为 。
参考答案:(1)5.0×10-7mol/L (2分) 5.0×10-11mol/L(2分)
(2)c( Na+) > c(CH3COO-) > c( OH-)> c(H+)(2分),
(3)Al3+ + 3H2O  Al(OH)3 + 3H+(2分) Al(OH)3;
Al(OH)3 + 3H+(2分) Al(OH)3;
(4)CH3OH (l)+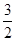 O2 (g) =CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1
O2 (g) =CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1
(5)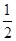 H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=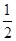 Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(2分)
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(2分)
(6)2 N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1 (2分)
或写成2N2H4 (g) + NO2 (g) =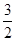 N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1
N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1
本题解析:(1)在纯水中存在电离平衡:H2O H++OH-,纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)=5.0×10-7mol/L. Kw=2.5×10-13;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)=Kw÷c(H+)=2.5×10-13÷5.0×10-3=5.0×10-11mol/L;(2)在CH3COONa的溶液中,由于CH3COO-水解消耗,所以c( Na+) > c(CH3COO-);水解消耗水电离产生的H+,破坏了水的电离平衡,最终使溶液中的OH-的浓度大于H+的浓度,c( OH-)> c(H+)。但是盐的水解程度是微弱的,盐电离产生的离子浓度远大于水电离产生的离子的浓度,所以c(CH3COO-) > c( OH-) c(H+)。故各离子的物质的量浓度由大到小的顺序是c( Na+) > c(CH3COO-) > c( OH-)> c(H+);(3)明矾的水溶液显酸性,其原因是Al3+ + 3H2O
H++OH-,纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)=5.0×10-7mol/L. Kw=2.5×10-13;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)=Kw÷c(H+)=2.5×10-13÷5.0×10-3=5.0×10-11mol/L;(2)在CH3COONa的溶液中,由于CH3COO-水解消耗,所以c( Na+) > c(CH3COO-);水解消耗水电离产生的H+,破坏了水的电离平衡,最终使溶液中的OH-的浓度大于H+的浓度,c( OH-)> c(H+)。但是盐的水解程度是微弱的,盐电离产生的离子浓度远大于水电离产生的离子的浓度,所以c(CH3COO-) > c( OH-) c(H+)。故各离子的物质的量浓度由大到小的顺序是c( Na+) > c(CH3COO-) > c( OH-)> c(H+);(3)明矾的水溶液显酸性,其原因是Al3+ + 3H2O  Al(OH)3 + 3H+;(4)燃烧热是1mol的可燃物完全燃烧产生稳定的氧化物时所放出的热量,根据题意可得甲醇燃烧热的热化学方程式为CH3OH (l)+
Al(OH)3 + 3H+;(4)燃烧热是1mol的可燃物完全燃烧产生稳定的氧化物时所放出的热量,根据题意可得甲醇燃烧热的热化学方程式为CH3OH (l)+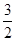 O2 (g)=CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1;(5)中和热是酸碱发生中和反应产生1mol的水时所放出的热量,由于1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为
O2 (g)=CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1;(5)中和热是酸碱发生中和反应产生1mol的水时所放出的热量,由于1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为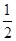 H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=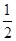 Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;(6)②×2-①,整理可得2 N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1或写为2N2H4 (g) + NO2 (g) =
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;(6)②×2-①,整理可得2 N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1或写为2N2H4 (g) + NO2 (g) =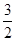 N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1。
N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1。
考点:考查弱电解质的电离、水的离子积常数、盐的水解、盖斯定律的应用、离子浓度比较、中和热、燃烧热的热化学方程式的书写的知识。
本题难度:一般
4、填空题 (16分)制备氢气可利用碘硫热化学循环法,其原理示意图如下。

(1)已知:①2SO3(g) 2SO2 (g) + O2 (g) △H1
2SO2 (g) + O2 (g) △H1
②H2SO4(l) SO3(g) + H2O(l) △H2
SO3(g) + H2O(l) △H2
2H2SO4(l) 2SO2 (g) + O2(g) +2H2O(l) △H3
2SO2 (g) + O2(g) +2H2O(l) △H3
则△H3= (用△H1和△H2表示)
(2)上述热化学循环制氢要消耗大量的能量,从绿色化学角度,能量供应的方案是 。
(3)碘化氢热分解反应为:2HI(g) H2(g)+I2(g) △H>0。则该反应平衡常数表达式:K= ;升温时平衡常数K (选填“增大”或“减小”)
H2(g)+I2(g) △H>0。则该反应平衡常数表达式:K= ;升温时平衡常数K (选填“增大”或“减小”)
(4)本生(Bunsen)反应中SO2和I2及H2O发生反应为:
SO2+I2+2H2O=3H++HSO4─+2I─;I─+I2 I3─。
I3─。
①当起始时,SO2为1mol,水为16mol,溶液中各离子变化关系如下图,图中a、b分别表示的离子是 、 。

②在水相中进行本生反应必须使水和碘显著过量,但易引起副反应将反应器堵塞。写出浓硫酸与HI发生反应生成硫和碘的化学方程式: 。
参考答案:(1)△H1+2△H2(2分)
(2)用廉价的清洁能源供给能量(用太阳能、风能、核能及生物质能等作为能源)(2分)
(3)c(H2)·c(I2)/c2(HI) (3分); 增大(2分);
(4)①H+、 I3- (各2分);②6HI+H2SO4(浓)=3I2↓+S↓+4H2O(3分)
本题解析:(1)①+②×2,整理可得2H2SO4(l) 2SO2 (g) + O2(g) +2H2O(l) △H3=△H1+2△H2;(2)上述热化学循环制氢要消耗大量的能量,从绿色化学角度,能量供应的方案是用廉价的清洁能源供给能量(用太阳能、风能、核能及生物质能等作为能源)(3)碘化氢热分解反应为:2HI(g)
2SO2 (g) + O2(g) +2H2O(l) △H3=△H1+2△H2;(2)上述热化学循环制氢要消耗大量的能量,从绿色化学角度,能量供应的方案是用廉价的清洁能源供给能量(用太阳能、风能、核能及生物质能等作为能源)(3)碘化氢热分解反应为:2HI(g) H2(g)+I2(g) △H>0。化学平衡常数是可逆反应达到平衡状态时,各种生成物浓度幂之积与各种反应物浓度幂之积的比。则该反应平衡常数表达式:K=c(H2)·c(I2)/c2(HI);由于该反应的正反应是吸热反应,根据平衡移动原理:升温时平衡向吸热的正反应方向移动,所以化学常数K增大;(4)①根据方程式中各种微粒的关系及图像显示的微粒的浓度变化可知:a表示的是H+;b表示的是I3-;②在水相中进行本生反应必须使水和碘显著过量,但易引起副反应将反应器堵塞。浓硫酸有强的氧化性,而HI有还原性,二者会发生氧化还原反应生成硫和碘,根据电子守恒和原子守恒,可得反应的化学方程式:6HI+H2SO4(浓)=3I2↓+S↓+4H2O。
H2(g)+I2(g) △H>0。化学平衡常数是可逆反应达到平衡状态时,各种生成物浓度幂之积与各种反应物浓度幂之积的比。则该反应平衡常数表达式:K=c(H2)·c(I2)/c2(HI);由于该反应的正反应是吸热反应,根据平衡移动原理:升温时平衡向吸热的正反应方向移动,所以化学常数K增大;(4)①根据方程式中各种微粒的关系及图像显示的微粒的浓度变化可知:a表示的是H+;b表示的是I3-;②在水相中进行本生反应必须使水和碘显著过量,但易引起副反应将反应器堵塞。浓硫酸有强的氧化性,而HI有还原性,二者会发生氧化还原反应生成硫和碘,根据电子守恒和原子守恒,可得反应的化学方程式:6HI+H2SO4(浓)=3I2↓+S↓+4H2O。
考点:考查化学方程式和热化学方程式的书写、化学方案的设计、化学平衡常数的表达及影响因素的知识。
本题难度:困难
5、填空题 (16分)Ⅰ.已知:
4Na(g)+3CO2(g)=2Na2CO3(l)+C(s,金刚石) △H=-1080.9kJ/mol
4Na(g)+CO2(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol
试写出固体Na2O与固体C(金刚石)反应得到气体Na和液态Na2CO3的热化学方程式 。
Ⅱ.硝基苯甲酸乙酯在OH— 存在下发生水解反应:O2NC6H4COOC2H5+OH-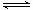 O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L ,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示:
t/s
| 0
| 120
| 180
| 240
| 330
| 530
| 600
| 700
| 800
|
α/%
| 0
| 33
| 42
| 49
| 59
| 73
| 74
| 75
| 75
|
回答下列问题:
(1)该反应在330~530s的平均反应速率为 (只列出算式,不做运算)。
(2)试计算某温度下该反应的平衡常数(写出计算过程)。
(3)为提高O2NC6H4COOC2H5的转化率,可以采取的措施有 ,(写2条)。
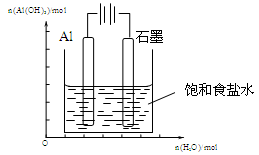
Ⅲ.(1)下图装置中,开始电解时,Al电极反应式为 ,石墨电极反应式为 。
(2)通电一段时间后测得有0.6mol电子转移,作出Al(OH)3物质的量与消耗H2O的物质的量的的图象(反应物足量,作出标注)。
参考答案:Ⅰ.3Na2O(s)+C(s,金刚石) =4Na(g)+Na2CO3(l) △H= —4.2kJ/mol
或6Na2O(s)+2C(s,金刚石) =8Na(g)+2Na2CO3(l) △H= —8.4kJ/mol
(2分,方程式1分,△H的表示1分,状态错误0分;“—”、焓变数值、单位错漏合扣1分)
Ⅱ.
(1) (2分,结果写单位也可,单位错漏扣1分, 计算出结果:3.5×10-5mol/(L.s)也给分,合理即给分)
(2分,结果写单位也可,单位错漏扣1分, 计算出结果:3.5×10-5mol/(L.s)也给分,合理即给分)
(2) O2NC6H4COOC2H5 + OH- 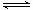 O2NC6H4COO- + C2H5OH
O2NC6H4COO- + C2H5OH
起始浓度(mol/L) 0.050 0.050 0 0
变化浓度(mol/L) 0.050 ×75% 0.050 ×75% 0.050 ×75% 0.050 ×75%
平衡浓度(mol/L) 0.050(1-75%) 0.050(1-75%) 0.050 ×75% 0.050 ×75% (1分)
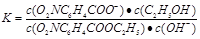 (1分)
(1分) 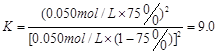 (2分)
(2分)
(共4分,其中:三段式1分,K的表达式1分,代入数值1分,计算结果1分。单位错漏扣1分,全部不带单位不扣分,有效数字错误不扣分,其他合理解法也给分)
(3)升高温度,增大OH-的浓度,移去产物(任答2条,共2分,合理即给分)
Ⅲ.(1)Al-3e-=Al3+或2Al-6e-=2Al3+(2分)
2H2O+2e-=2OH-+H2 ↑或6H2O+6e-=6OH-+3H2 ↑
或 2H++2e-=H2 ↑或 6H++6e-=3H2 ↑(2分)
(2)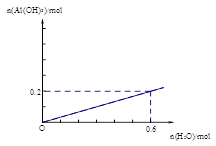 (2分,其中,曲线1分,标注1分)
(2分,其中,曲线1分,标注1分)
本题解析:Ⅰ 由盖斯定律可知:固体Na2O与固体C(金刚石)反应得到气体Na和液态Na2CO3的热化学方程式:3Na2O(s)+C(s,金刚石) =4Na(g)+Na2CO3(l) △H= -3/2×(-357.5kJ/mol)+1/2(-1080.9kJ/mol)= —4.2kJ/mol;Ⅱ、(1)根据速率公式: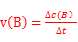 ,该反应在330~530s的平均反应速率为
,该反应在330~530s的平均反应速率为 mol/(L.s);(2)试计算某温度下该反应的平衡常数,由题意可知: O2NC6H4COOC2H5 + OH-
mol/(L.s);(2)试计算某温度下该反应的平衡常数,由题意可知: O2NC6H4COOC2H5 + OH- 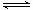 O2NC6H4COO- + C2H5OH
O2NC6H4COO- + C2H5OH
起始浓度(mol/L) 0.050 0.050 0 0
变化浓度(mol/L) 0.050 ×75% 0.050 ×75% 0.050 ×75% 0.050 ×75%
平衡浓度(mol/L) 0.050(1-75%) 0.050(1-75%) 0.050 ×75% 0.050 ×75%
则K=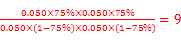 ;(3)为提高O2NC6H4COOC2H5的转化率,即应是平衡正向移动,O2NC6H4COOC2H5+OH-
;(3)为提高O2NC6H4COOC2H5的转化率,即应是平衡正向移动,O2NC6H4COOC2H5+OH-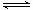 O2NC6H4COO-+C2H5OH为水解反应是吸热反应,故升高温度平衡正向移动,或增大OH-浓度使平衡正向移动增大O2NC6H4COOC2H5的转化率,或分离出乙醇等产物也能使平衡正向移动,故应采取条件为:升高温度或增大OH-浓度或分离出一部分产物;Ⅲ.(1)图装置中,Al电极为阳极,故该电极为Al放电,发生电极反应为2Al-6e-=2Al3+,阴极为水中H+放电,故电极反应为:6H++6e-=3H2 ↑或6H2O+6e-=6OH-+3H2 ↑;(2)通电一段时间后测得有0.6mol电子转移,则消耗水为0.6mol,产生Al(OH)3为0.2mol,故图象为:
O2NC6H4COO-+C2H5OH为水解反应是吸热反应,故升高温度平衡正向移动,或增大OH-浓度使平衡正向移动增大O2NC6H4COOC2H5的转化率,或分离出乙醇等产物也能使平衡正向移动,故应采取条件为:升高温度或增大OH-浓度或分离出一部分产物;Ⅲ.(1)图装置中,Al电极为阳极,故该电极为Al放电,发生电极反应为2Al-6e-=2Al3+,阴极为水中H+放电,故电极反应为:6H++6e-=3H2 ↑或6H2O+6e-=6OH-+3H2 ↑;(2)通电一段时间后测得有0.6mol电子转移,则消耗水为0.6mol,产生Al(OH)3为0.2mol,故图象为: 。
。
考点:化学反应原理综合。
本题难度:困难