微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在下列事实中,什么因素影响了化学反应的速率??
(1)集气瓶中有H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸______________;
(2)黄铁矿煅烧时要粉碎成细小的矿粒__________________;
(3)KI晶体和HgCl2晶体混合后无明显现象,若一起投入水中,很快生成红色HgI2________________;
(4)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体__________________;
(5)同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢__________________;
(6)同样大小的石灰石分别在0.1mol/L的盐酸和1mol/L的盐酸中反应速率不同_______________;
(7)夏天的食品易变霉,冬天就不易发生该现象__________________。
参考答案:(1)光
(2)反应物的接触面积
(3)在溶液中,水作溶剂,增大了接触面积
(4)催化剂
(5)反应物本身的性质
(6)反应物的浓度
(7)反应温度
本题解析:
本题难度:一般
2、填空题 某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g)?2SO3(g),△H<0的正、逆反应速率的影响如图所示:

(1)加催化剂对反应速率影响的图象是______(填序号,下同),平衡______移动.
(2)升高温度对反应速率影响的图象是______,平衡向______方向移动.
(3)增大反应容器体积对反应速率影响的图象是______,平衡向______方向移动.
(4)增大O2的浓度对反应速率影响的图象是______,平衡向______方向移动.
参考答案:(1)催化剂只影响反应速率,不影响化学平衡,所以加入催化剂后正逆反应速率同时增大且相等,化学平衡不发生移动,所以C正确;
故答案为:C;不;
(2)升高温度后,正反应速率和逆反应速率都增大,由于该反应为放热反应,平衡向着逆反应方向移动,说明逆反应速率大于正反应速率,所以A正确,
故答案为:A;逆反应;
(3)该反应为体积缩小的反应,增大反应容器体积,反应体系压强减小,正逆反应速率都会减小,平衡向着体积增大的逆反应方向移动,说明逆反应速率减小幅度减小,即逆反应速率大于正反应速率,满足该变化的图象为D,
故答案为:D;逆反应;
(4)增大O2的浓度的瞬间,逆反应速率不变,正反应速率增大,平衡向着正反应方向移动,满足该变化的图象为B,
故答案为:B;正反应.
本题解析:
本题难度:一般
3、实验题 (16分)某小组同学利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,倒入大试管中迅速振荡混合均匀,再加入硫酸,开始计时,通过测定混合溶液褪色所需时间来判断反应的快慢(已知反应方程式为:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O)。该小组设计了如下方案。
编号
| H2C2O4溶液
| KMnO4溶液
| 硫酸溶液
| 温度/℃
|
| 浓度
(mol/L)
| 体积
(mL)
| 浓度
(mol/L)
| 体积
(mL)
|
|
|
①
| 0.10
| 2.0
| 0.010
| 4.0
| 4mL 4mol/L
| 25
|
②
| 0.20
| 2.0
| 0.010
| 4.0
| 4mL 4mol/L
| 25
|
③
| 0.20
| 2.0
| 0.010
| 4.0
| 4mL 4mol/L
| 50
|
(1)探究温度对化学反应速率影响的组合实验编号是__________(填编号,下同);探究反应物浓度对化学反应速率影响的组合实验编号是__________。
(2)该小组同学由此实验发现反应进行一些时间后,有一时间段反应速率不断加快。同学们分析除了反应放热使体系温度升高外,可能还有其它原因,他们联想到教材上的科学探究实验,推断出反应混合溶液中的__________(填化学式)也加速了此反应的进行。
(3)上述实验①中充分反应后H2C2O4过量,假设理论上能通过用酸性KMnO4溶液滴定的方法来测定反应混合液中过量的H2C2O4,请回答下列问题:
①取用反应混合液的滴定管用__________滴定管(填“酸式”或“碱式”,下同),盛装KMnO4溶液的滴定管用__________滴定管。
②下列操作中可能使测出的H2C2O4剩余量比理论值偏低的是__________。
A.读取酸性KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
B.滴定前盛放反应混合液的锥形瓶用蒸馏水洗净但没有干燥
C.盛装KMnO4溶液的滴定管滴定前有气泡,滴定后气泡消失
D.盛装KMnO4溶液的滴定管未润洗就直接注入酸性KMnO4溶液
③此滴定实验是否需要滴加指示剂________(填“是”或“否”);怎么确定此滴定的终点:_________。
参考答案:(1)②③ ;①② ;(2)MnSO4 (3)①酸式 酸式 ②A
③否;当加入最后一滴酸性KMnO4溶液时,锥形瓶内溶液由无色变为浅紫色,且30s内不褪色。
本题解析:(1)对表格中的数据进行观察得知:探究温度对化学反应速率影响的组合实验编号是②③;探究反应物浓度对化学反应速率影响的组合实验编号是①②;(2)由于在反应过程中产生了MnSO4,因此可推断出反应混合溶液中的MnSO4也加速了此反应的进行。(3)①由于反应后溶液中H2C2O4过量,即溶液显酸性,所以取用反应酸性混合液的滴定管用酸式滴定管;②A.读取酸性KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数,则读数偏小,使测出的H2C2O4剩余量比理论值偏低,正确;B.滴定前盛放反应混合液的锥形瓶用蒸馏水洗净但没有干燥,不能产生任何误差,错误;C.盛装KMnO4溶液的滴定管滴定前有气泡,滴定后气泡消失,则消耗的KMnO4溶液体积偏大,因此使测出的H2C2O4剩余量比理论值偏高;错误;D.盛装KMnO4溶液的滴定管未润洗就直接注入酸性KMnO4溶液,则消耗的标准KMnO4溶液体积偏大,因此使测出的H2C2O4剩余量比理论值偏高;错误。③由于KMnO4溶液是紫色的,当与草酸反应后产物是无色的,因此就可以利用其本身的颜色变化来显示滴定终点,故此滴定实验不需要滴加指示剂;滴定的终点的判断方法是当加入最后一滴酸性KMnO4溶液时,锥形瓶内溶液由无色变为浅紫色,且30s内不褪色。就达到了滴定终点。
考点:考查外界条件对化学反应速率的影响、滴定法在测定物质的组合、指示剂的选择、滴定终点的判断。
本题难度:困难
4、实验题 教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
?
实验序号
| A溶液
| B溶液
|
①
| 20 mL 0.1 mol·L-1H2C2O4溶液
| 30 mL 0.01 mol·L-1KMnO4溶液
|
②
| 20 mL 0.2 mol·L-1
H2C2O4溶液
| 30 mL 0.01 mol·L-1KMnO4溶液
|


(1) 该实验探究的是?因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是?- ?(填实验序号)。
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),
则在2 min末,c(MnO4-)=?mol/L。
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定?来比较化学反应速率。
(4)小组同学发现反应速率总是如右图,其中t1~t2时间内速?率变快的主要原因可能是:①该反应放热、②?。
参考答案:(1)浓度? ②>①
(2)0.0052
(3)KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间
(4)产物Mn2+(或MnSO4)是反应的催化剂
本题解析:(1)从题中可以看出H2C2O4溶液的浓度不同,KMnO4溶液而的浓度相同,说明该实验探究的是浓度对对化学反应速率的影响,并且浓度越大,反应速率越快,相同时间内针筒中所得CO2的体积为②>①;(2)中,在2 min末收集了4.48 mL CO2(标准状况下),即得到了0.0002mol CO2,根据2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可知,消耗了0.00004mol MnO4-,则剩下的
(30*0.010/1000)-0.00004=0.00026mol,所以c=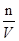 =
=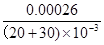 ?mol/L=0.0052 mol/L;(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率;(4)刚开始反应的时候,速率并不快,但是后来逐渐加快,这可能是由于反应放热,或者是生成了具有催化作用的物质,例如Mn2+(或MnSO4)。
?mol/L=0.0052 mol/L;(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率;(4)刚开始反应的时候,速率并不快,但是后来逐渐加快,这可能是由于反应放热,或者是生成了具有催化作用的物质,例如Mn2+(或MnSO4)。
点评:该题考查了影响化学反应速率的原因,是一道综合题,这有利于提高学生的综合分析能力,但是该题的难度不大,只有最后一个空有点难度,考生在解答这个空时,要联想到催化剂的作用就可以迎刃而解。
本题难度:一般
5、选择题 把下列四种x的溶液,分别加入盛有10 mL、2 mol/L的盐酸的烧杯中,并均加水稀释至50mL,此时x和盐酸缓和地进行反应,其中反应速率最大的是:
A.20 mL,2 mol/L
B.20 mL,3 mol/L
C.10 mL,5 mol/L
D.10 mL,3 mol/L