微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 已知A为常见金属单质,X、Y为常见非金属单质,X、E、F、G常温下为气体,C通常情况下为常见液体,B是一种盐, 受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解 质,构成原电池。有关物质之间的转化关系如图:(注意:其中有些反应的条件及部分生成物被略去)
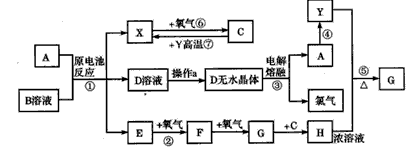
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为____。
(2)从D溶液制备D的无水晶体的“操作a”为___。
(3)反应②的化学方程式为____。
(4)反应⑤的化学方程式为____。
(5)原电池反应①中正极的电极反应式为____。
参考答案:(1) 2Mg+CO2 2MgO+C
2MgO+C
(2) 将D溶液在HCl气流中蒸干
(3) 4NH3+5O2 4NO+6H2O
4NO+6H2O
(4) C+4HNO3(浓)==CO2↑+4NO2↑+2H2O
(5) 2NH4++2e-==2NH3↑+H2↑
本题解析:
本题难度:一般
2、推断题 已知A是一种常见非金属单质,B是氧化物,E是A的氢化物,D是A的最高价氧化物对应的水化物,其转化关系如图所示
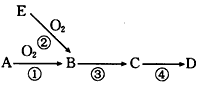
(1)若E、D的水溶液均呈酸性,试写出反应③的化学方程式___________________。
(2)若D是一种难溶于水的物质,试写出反应③的离子方程式____________。
(3)若E、D的水溶液均呈酸性,①~④的反应中属于氧化还原反应的是____________。
参考答案:(1)2SO2+O2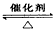 2SO3
2SO3
(2)SiO2+2OH-=SiO32-+H2O
(3)①②③
本题解析:
本题难度:一般
3、推断题 下图中A~J分别代表有关反应中的一种物质,它们均为中学化学中的常见物质。已知A~E和F~J中分别含有同一种元素。请填写下列空白
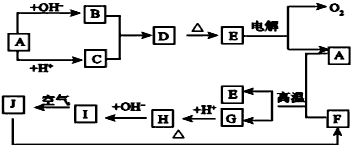
(1)画出A的原子结构示意图_________________
(2)指出G在元素周期表中的位置关系__________________
(3)写出B和C反应的离子方程式___________________________
(4)写出A和F发生反应的化学方程式___________________________
参考答案:(1)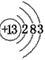
(2)第4周期,VIII族
(3)Al3++3AlO2-+6H2O==4Al(OH)3↓
(4)2Al+Fe2O3 2Fe+Al2O3
2Fe+Al2O3
本题解析:
本题难度:一般
4、填空题 A~L是由6种短周期元素且成的物质,各物质之间有如下转化关系:
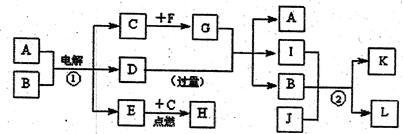
已知:
(a)C、E是气体单质,E是一种理想的清洁能源,F是日常生活中的常用金属;
(b)J是能使澄清石灰水变浑浊的无色无味气体;
(c)化合物A、D、I、L的焰色反应显黄色;
(d)白色沉淀K既溶于H溶液,又能溶于D溶液;
(e)反应①是工业上生产D和C的重要方法
请回答下列问题:
(1)写出F的化学式:?,D的电子式:?
(2)写出下列有关反应的离子方程:
反应①:? ?;
?;
过量J与I反应:?
(3)G溶液呈?性(填“酸”、“碱”或“中”),请用离子方程式表示其原因: ?
参考答案:(1)Al?氢氧化钠的电子式?
(2)氯化钠溶液的电解和过量二氧化碳与偏铝酸钠溶液生成沉淀和碳酸氢钠离子方程式
(3)酸(这空1分,其余空都为2分)铝离子的水解离子方程式
本题解析:略
本题难度:一般
5、推断题 下方图中A~K均为中学化学中常见的物质,其中A和F是金属单质,D是最常见的溶剂。I为黄绿色气体,C的焰色反应呈黄色,K是红褐色固体。
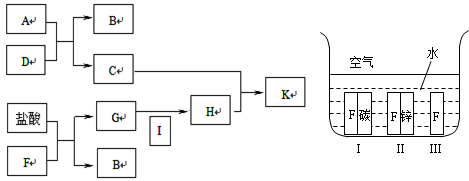
(1)A元素在周期表中位于第?周期?族?。
(2)G+I→H的离子方程式为?。
(4)如上方右图所示,F处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,该金属被腐蚀的速率由快到慢的顺序是(填序号)_______________。
参考答案:(6分)
(1)第? 3?周期? ⅠA?族。
(2)离子方程式为? 2Fe2++Cl2=2Fe3++2Cl-?。
(4)由快到慢的顺序是(填序号) Ⅰ>Ⅲ>Ⅱ 。
本题解析:C的焰色反应呈黄色,应含有Na元素,则A应为Na,D是最常见的溶剂,应为H2O,A和D反应生成NaOH和H2,则C为NaOH,B为H2,I为黄绿色气体,应为Cl2,K是红褐色固体,应为Fe(OH)3,则H为FeCl3,G为FeCl2,F为Fe,
(1)由以上分析可知A为Na,原子核外有3个电子层,最外层电子数为1,应位于周期表第三周期、ⅠA族,
故答案为:三;ⅠA;
(2)D为H2O,I为Cl2,二者反应生成HCl和HClO,反应的离子方程式为Cl2+H2O=H++Cl-+HClO,G为FeCl2,具有还原性,可被Cl2氧化生成FeCl3,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:Cl2+H2O=H++Cl-+HClO; 2Fe2++Cl2=2Fe3++2Cl-;
(3)G为FeCl2,含有Fe2+,加入KSCN溶液不变色,但Fe2+具有还原性,可被H2O2氧化为Fe3+,溶液变红,
故答案为:H2O2、KSCN;
(4)金属腐蚀时,原电池腐蚀比化学腐蚀快,当铁为原电池负极时,易被氧化而腐蚀,当为原电池正极时,得到保护,则该金属被腐蚀的速率由快到慢的顺序是Ⅰ>Ⅲ>Ⅱ,故答案为:Ⅰ>Ⅲ>Ⅱ。
点评:本题考查元素化合物的推断,难度不大,可根据物质的特殊颜色或特殊化学反应推断元素或化合物,注意“题眼”的确定,准确确定“题眼”是解推断题的关键,学习中注意把握金属腐蚀快慢的比较。
本题难度:困难