微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
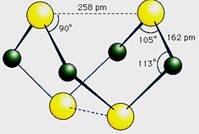
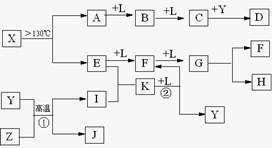
1、填空题 已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体,Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁铁矿的主要成分,D、H、K均是重要的工业产品,X分子的球棍模型如图所示,图中部分反应条件已略去。
 ?
?
试回答下列问题
(1)写出化学式:D?X ?。
(2)E的电子式为:?。
(3)写出化学方程式:①?;②?。
参考答案:
(1)H2SO4; S4N4(或N4S4)(2)
(3)3Fe+4H2O(g) Fe3O4+4H2; 4NH3+5O2
Fe3O4+4H2; 4NH3+5O2 4NO+6H2O
4NO+6H2O
本题解析:
本题考查无机推断。A为淡黄色固体,且为单质,可知为硫,B的相对分子质量比A大32,可以推出B为SO2,C的相对分子质量比B大16,C为SO3,J是磁铁矿的主要成分,J是Fe3O4,从框图可知,L是O2,Y是一种常见的液体,C与Y生成重要化工产品D,可知Y是H2O,D是H2SO4,由反应①的条件和产物J可以猜测反应①为3Fe+4H2O(g) Fe3O4+4H2,Z是Fe,I是H2。H、K均是重要的工业产品,从E、F、G之间的转化特征,可知E是N2,N2与H2反应生成K,K是NH3,反应②是NH3与O2的催化氧化,生成NO和H2O,符合框图,F是NO,NO与O2继续反应生成NO2,G是NO2,NO2与水反应生成硝酸和NO,H是硝酸。最后由A和E,以及X分子的球棍模型可得X是S4N4。
Fe3O4+4H2,Z是Fe,I是H2。H、K均是重要的工业产品,从E、F、G之间的转化特征,可知E是N2,N2与H2反应生成K,K是NH3,反应②是NH3与O2的催化氧化,生成NO和H2O,符合框图,F是NO,NO与O2继续反应生成NO2,G是NO2,NO2与水反应生成硝酸和NO,H是硝酸。最后由A和E,以及X分子的球棍模型可得X是S4N4。
本题难度:简单
2、推断题 下图中的每一方格表示相关的一种反应物或生成物。其中B 是一种单质,其余物质也都是含B元素的化合物。C是一种钠盐,E是C对应的酸,B的结构类似金刚石,D为B的氧化物(其他不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去),

请填写空白:
(1)A、D、E的化学式分别为_______、_________、_________。
(2)A和B的互相转化在工业上有什么实际意义___________?
(3)写出D→C反应的化学方程式:_______________。
(4)写出E→D反应的化学方程式:_______________。
参考答案:(1)SiCl4 ;SiO2 ;H2SiO3
(2)粗硅提纯
(3)SiO2+ 2NaOH=Na2SiO3+H2O
(4) H2SiO3 SiO2+ H2O
SiO2+ H2O
本题解析:
本题难度:一般
3、填空题 (15分)A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2 O已略去)。请填空:

(1)若D是生产、生活中用量最大、用途最广的金属单质,加热蒸干棕黄色的B的溶液不
能得到B,则B的化学式可能是________。用有关离子方程式解释 B溶液显酸性的原因是:?;
(2)若A是一种碱性气体,常用作制冷剂,B和D为空气的主要成分,则反应②的化学方程式为?;
(3)若 D的氯碱
D的氯碱 工
工 业的主要产品,B有两性,则反应③的离子方程式是?;
业的主要产品,B有两性,则反应③的离子方程式是?;
(4)若D为酸或酸性气体,则A、C可以是??,?;
(5)若C是一种温室气体,D是空气的主要成分之一,1 mol黑色固体A完全燃烧放出393.5kJ热量,1 molB气体完全燃烧放出283.0kJ热量,则A→B反应的热化学方程式为?。
参考答案:
本题解析:略
本题难度:一般
4、填空题 (8分)下图中每一方框中的字母代表一种反应物或生成物(部分产物未列出):
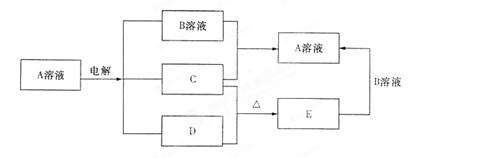
已知C是紫红色金属固体,B的浓溶液和稀溶液都是有强氧化性。
(1)A的化学式是?,E化学式是?;
(2)电解反应的化学(或离子)方程式是?;
(3)对200ml 1mol/L的A溶液进行电解,当有0.02mol电子发生转移时,溶液的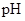 为
为
?(假设溶液体积不变)。
参考答案:(8分)
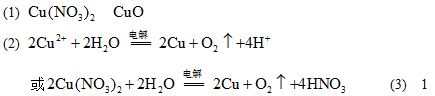
本题解析:略
本题难度:一般
5、填空题 已知A、B、C、D、E为中学化学常见的五种物质,均含元素Y,且Y在这些物质中所呈化合价依次升高,其中只有B为单质.若在常温下将气体D通入水中可以发生反应,生成C和E.工业上以A、空气和水为原料,通过催化氧化法制取E.请回答以下问题:
(1)A分子的空间构型为______;Y在周期表中的位置______;
(2)写出气体D通入水中的化学反应方程式______;
(3)E具有不稳定性,因此实验室中保存E的方法是______;
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出此反应的化学方程式:______,当反应中转移的电子为3mol时,被氧化的A在标准状况下的体积为______L.
参考答案:A、B、C、D、E为中学化学常见的五种物质,均含元素Y,且Y在这些物质中所呈化合价依次升高,说明Y有多种化合价,可能为N元素或Cl元素,又工业上以A、空气和水为原料,通过催化氧化法制取E,应为氨的催化氧化制备硝酸,则A为NH3、B为N2、C为NO、D为NO2、E为HNO3,则
(1)A为NH3,分子的空间构型为三角锥形,元素Y为N元素,原子核外有2个电子层,最外层电子为5,则位于周期表第二周期第VA族,故答案为:第二周期第VA族;
(2)D为NO2,与水发生:3NO2+H2O=NO+2HNO3,为NO2的自身氧化还原反应,故答案为:3NO2+H2O=NO+2HNO3;
(3)E为HNO3,见光易分解,在实验室中应保存在棕色试剂瓶中并置于冷暗处,
故答案为:贮存在棕色瓶中,置于冷暗处;
(4)Cl2具有强氧化性,遇氨气发生氧化还原反应生成N2,同时有NH4Cl生成,反应的化学方程式为8NH3+3Cl2=6NH4Cl+N2,当有3molCl2参加反应,则有2molNH3被氧化,转移6mol电子,所以转移3mol电子,有1molNH3被氧化,体积为22.4L,
故答案为:8NH3+3Cl2=6NH4Cl+N2;22.4L.
本题解析:
本题难度:一般