微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 X、Y、Z、W都是中学化学中常见物质,其中X、Y、Z?均含有同一种元素,在一定条件下相互转化关系如下(部分生成物已略去)。
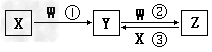
(1)若X、W均为单质,且X为气体,Y的水溶液中滴入KSCN溶液后变红。反应③的离子方程式是_________________;
ⅱ)Y的水溶液显酸性,原因是(用?离子方程式表示)_____________;将Y溶液蒸干、灼烧,得到的固体物质是_____________________。
(2)若X为氯碱工业的产品之一,Y为工业上生产普通玻璃的一种原料。
Ⅰ、氯碱工业中制备X的化学方程式是__________________。
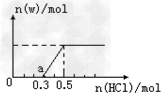
Ⅱ、先将一定量的W气体通入到300mL?X的溶液中,再在所得溶液中逐滴加入稀盐酸至过量,产生的气体与反应的HCl两者物质的量的关系如图所示(气体的溶解和HCl的挥发忽略):
ⅰ)O点溶液中所含溶质的化学式为___________________;
ⅱ)a点溶液中H+和OH-浓度的大小关系为___________________;
ⅲ)标准状况下,通入气体W的体积为________________。
参考答案:(1)ⅰ)2?Fe2+?+?Cl2?==2Fe2+?+?2?Cl–?;ⅱ)?Fe3+?+3H2O Fe(OH)3+?3H+;Fe2O3
Fe(OH)3+?3H+;Fe2O3
(2)Ⅰ、2NaCl?+?2H2O Cl2↑?+?H2↑+?2NaOH;
Cl2↑?+?H2↑+?2NaOH;
Ⅱ、ⅰ)?NaOH、Na2CO3?;ⅱ)c(H+)<c(OH–);ⅲ)?4.48L
本题解析:
本题难度:一般
2、填空题 (14分)D、E为中学化学常见的金属单质,在一定条件下C、D间能发生反应.各物质转化关系如下图:
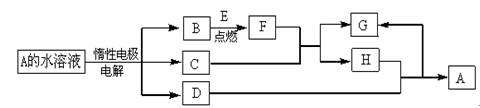
⑴B的同素异形体的名称为:_____________;H的化学式为:_____________.
⑵写出D与H反应的离子方程式__________?___.
⑶用惰性电极电解A 溶液的阳极反应式为:_____________?.
⑷检验H和G的混合溶液中含有G的阳离子的试剂可以是:_____________.
a.氯水和KSCN溶液? b.氢氧化钠溶液? c.酸性KMnO4溶液
⑸用惰性电极电解一定浓度的A溶液,通电一段时间后,向所得溶液中加入9.8 g含A中金属阳离子的弱碱固体后恰好恢复到电解前的浓度和pH.则电解过程中转移电子的物质的量为_____________mol, 收集到标准状况下的气体体积为_____________.
参考答案:
本题解析:略
本题难度:一般
3、实验题 A~K为中学化学常见的物质,它们之间的转化关系如下图,部分生成物和反应条件等省略。已知C、D是由元素X、Y、Z中的两种组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色气体且不能燃烧,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。请回答下列问题:
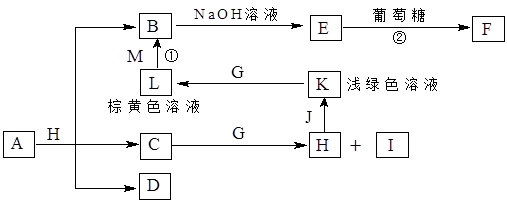
1)写出A的化学式______________。
(2)比较Y与Z的原子半径大小:_________>_______(填写元素符号)。
(3)检验L溶液中金属阳离子的方法是__________________________________。
(4)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体。请写出该反应的化学方程式
________________________________________________________
参考答案:(1)CuCO3或Cu2(OH)2CO3或Cu(OH)2·CuCO3;
(2)C>O
(3)取少量L溶液于试管,滴加KSCN溶液,如溶液呈血红色,证明溶液含Fe3+
(或其他合理答案)
(4)3Cu2O+14HNO3 6Cu(NO3)2+2NO↑+7H2O(方程式3分,其他每空2分)
6Cu(NO3)2+2NO↑+7H2O(方程式3分,其他每空2分)
本题解析:本题的关键是综合题目所给信息,判定各物质的化学式
依据G为氯气、I有漂白作用可初步判定C+G→H+I的反应可能是:Cl2+H2O=HCl+HClO;
盐酸与金属J生成的浅绿色溶液只能是FeCl2溶液:Fe+2HCl=FeCl2+H2↑;FeCl2被氯气氧化为棕黄色溶液L:FeCl3;而反应①是常用于制作印刷电路板,则知道M为铜,即:Cu+2FeCl3=2FeCl2+CuCl2;生成的B溶液CuCl2与NaOH生成Cu(OH)2与葡萄糖生成砖红色的F :Cu2O
A与盐酸生成CuCl2、水及D物质:X元素为H,与氧元素组成了C,也就是水;由Y、Z原子最外层电子数之和为10,可判定另一元素的最外层电子数为4,且可与氢元素形成无色且不可燃烧的气体D,也只能是CO2气体,所以Y、Z元素分别为C、O;
所以A为碳酸盐、铜盐,与盐酸生成了CuCl2、H2O及CO2,故A可能是CuCO3或Cu2(OH)2CO3
(2)同周期自左向右,原子半径逐渐减小
(3)考查铁离子的检验
(4)考查Cu2O与硝酸反应的方程式的书写及配平
本题难度:一般
4、选择题 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列推断正确的是
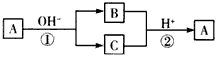
[? ]
A.X元素为铝
B.反应①和②互为可逆反应
C.X元素可能是金属,也可能是非金属
D.反应①和②一定为氧化还原反应
参考答案:D
本题解析:
本题难度:一般
5、简答题 A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体.
(1)写出A、C、E物质的化学式.
A______C______E______
(2)试管壁上如果沾有A,应用______洗涤.
(3)对于C:
①将C分别通入下列溶液时有何现象,并说明产生这种现象的原因.
A.澄清石灰水:现象______
原因______
B.品红溶液:现象______
原因______
②若将C和氯气等体积混合,然后通入品红溶液,现象与①有何不同______,用化学方程式或简要文字说明不同的原因______.
(4)浓的E溶液在常温下为粘稠的液体,且E具有强吸水性、强氧化性、强脱水性.则
①E表现吸水性时,可做干燥剂,下列物质可用E干燥的是______
A.氨气B.硫化氢C.氢气D.二氧化硫
②浓E溶液与铜反应时,E除了表现强氧化性外,还表现了______性.
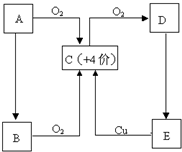
参考答案:物质A是一种淡黄色的固体,中学阶段常见有过氧化钠或硫,A能与氧气反应,则应为S,则C为SO2,由此可知D为SO3,E为H2SO4,B由A生成,与氧气反应也可生成SO2,则可知B应为H2S,
(1)由以上分析可知A为S,B为SO2,E为H2SO4,故答案为:S;SO2;H2SO4;
(2)S不溶于水,微溶于酒精,易溶于二硫化碳,可与热的氢氧化钠反应,则试管上沾有S,可用CS2或热的NaOH溶液洗涤,故答案为:CS2或热的NaOH溶液;
(3)①.A.二氧化硫可与澄清石灰水反应生成亚硫酸钙沉淀,可观察到溶液变浑浊,反应的化学方程式为SO2+Ca(OH)2=CaSO3↓+H2O,
故答案为:变浑浊;SO2+Ca(OH)2=CaSO3↓+H2O;
B.二氧化硫具有漂白性,可使品红褪色,故答案为:褪色;SO2具有漂白性;
②二氧化硫具有还原性,可与氯气发生氧化还原反应生成硫酸和盐酸,反应的方程式为SO2+Cl2+2H2O=H2SO4+2HCl,将二者混合通入品红中,溶液不褪色,
故答案为:品红不褪色;SO2+Cl2+2H2O=H2SO4+2HCl;
(4)①浓硫酸具有吸水性,可用作干燥剂,但不能干燥碱性或具有强还原性气体,可干燥二氧化硫和氢气,故答案为:CD;
②浓硫酸与铜反应生成硫酸铜和二氧化硫,反应中浓硫酸表现为酸性和强氧化性,故答案为:酸.
本题解析:
本题难度:一般