微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (9分)10 mL含有a mol HCl的稀盐酸和10 mL含有b molNa2CO3的稀溶液,按下图方式分别缓慢向对方溶液中滴加,并不断摇动试管,试分析下表并完成各题:(题中气体体积均在标准状况下测定,且不考虑气体在水中的溶解)
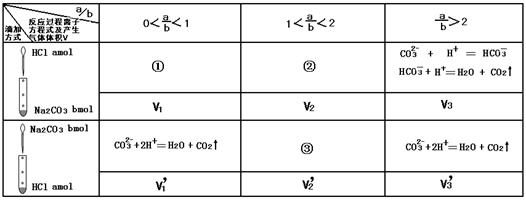
(1)表中对应过程的离子反应方程式:
①?;③?。
(2)上述所测六种情况下气体体积V1、V1"、V2、V2"、V3、V3"中为0的有?。
(3)V3与V3"的大小关系为V3?V3"(用“<” 、“>” 或“=”填空)
(4)若a=0.01,b=0.008,则V2=?mL、V2"=?mL。
参考答案:(1)①CO32-+H+ = HCO3-(1分)?③CO32-+2H+ = CO2↑+H2O(1分)
(2)V1(1分)?(3)=(2分)?(4)V2=44.8mL(2分)、V2"=112mL(2分)
本题解析:(1)碳酸钠和盐酸的反应是分步进行的,所以①、③的离子方程式是CO32-+H+ = HCO3-。反应③中盐酸是过量的,所以反应的离子方程式是CO32-+2H+ = CO2↑+H2O。
(2)由于碳酸钠和盐酸反应是分步进行的,所以若a小于b,则V1=0,其余都不是0。
(3)由于a大于2b,所以不论怎么滴加,生成的CO2都是相同的,即V3=V3"。
(4)若a=0.01,b=0.008,则根据方程式CO32-+H+ = HCO3-、HCO3-+H+ = CO2↑+H2O可知在反应②中生成的CO2是(0.01-0.008)mol=0.002mol,标准状况下的体积是44.8ml;而在反应③中根据方程式CO32-+2H+ = CO2↑+H2O可知,生成的CO2是0.01mol÷2=0.005mol,所以标准状况下的体积是0.005mol×22.4L/mol=0.112L=112ml。
本题难度:一般
2、选择题 少量钠应保存在(?)
A.密闭容器中
B.水中
C.煤油中
D.汽油中
参考答案:C
本题解析:钠的性质很活泼,极易和空气中的氧气反应生成氧化钠,所以应密封保存;钠的密度小于煤油的密度,且和煤油不反应,所以金属钠通常保存在 煤油里,答案选C。
点评:该题是常识性知识的考查,难度不大。明确钠的性质,然后有针对性的选择保存方法是答题的关键。
本题难度:简单
3、选择题 一小块钠置于空气中,有下列现象:①变成白色粉末,②变暗,③变成白色固体,④变成液体,上述现象出现的先后顺序是
A.①②③④
B.②③④①
C.②③①④
D.③②④①
参考答案:B
本题解析:现象的本质是发生了什么变化,有什么样的变化就应该有什么样的现象相对应,钠置于空气中发生的变化如下:Na→Na2O→NaOH→Na2CO3·10H2O→Na2CO3,答案选B。
点评:本题考查的是钠的基本性质,比较简单。
本题难度:简单
4、计算题 在空气中暴露过的NaOH固体,经分析知其含水7.65%,含Na2CO34.32%,其余是NaOH。若将1g该样品放入含有HCl3.65g的盐酸溶液中使其完全反应后,多余的酸再用50g2%的NaOH溶液恰好中和。蒸干所得溶液,可得固体多少克?
参考答案:设可得固体质量为x。
根据氯元素守恒可得如下关系式:
HCl —NaCl
36.5 ?58.5
3.65 g x
36.5∶3.65 g=58.5∶x
x="5.85" g
最终可得固体5.85 g
本题解析:该题数据众多,相关的反应也较多,但细心分析一下所进行的反应产物就会发现,最后得到的固体均为NaCl,我们可以用氯元素守恒快速解题。
本题难度:一般
5、选择题 下列实验叙述正确的是(?)
A.新制氯水放置数天,溶液中的Cl2分子数目不变
B.久置的氯水可使蓝色石蕊试纸先变红后褪色
C.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟
D.钠投入硫酸铜溶液中有红色粉末产生
参考答案:C
本题解析:A新制氯水放置数天后会发生反应:Cl2+H2O="HCl+HClO," HClO光照分解产生氧气和HClO, HClO光照分解产生氧气和HCl,浓度降低。故放置后溶液中的Cl2分子数目减少。错误。B久置的氯水次氯酸浓度降低,氧化性减弱,只能使可使蓝色石蕊试纸变红。错误。C铜丝在氯气里剧烈燃烧,生成棕黄色的烟。正确。D钠投入硫酸铜溶液中时,先与水发生反应生成氢氧化钠和氢气,然后是氢氧化钠与硫酸铜发生复分解反应产生氢氧化铜蓝色沉淀。而并非将铜置换出来。错误。
本题难度:一般