微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)T、X、Y、Z、Q、R、W为周期表前四周期的元素,原子序数依次递增。已知:
①W的原子序数为29,其余元素均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子电子占据三种能量不同的轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤在该元素所在的周期中,Q的基态原子的第一电离能最小;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)X、Y、Q三种元素的电负性由大到小的顺序是?(用元素符号表示)。
(2)与W同周期的元素中,原子最外层电子数与W元素原子相同的元素还有?(填元素符号)。由W2+制取[W(YT3)4]2+的离子方程式为?。
(3)T、X、Z三种元素组成的一种化合物M是蚂蚁分泌物和蜜蜂的分泌液中含有的物质,俗称蚁酸,它的分子式为XT2Z2,则该分子的X原子采取?杂化,1mol M分子中δ键和π键的个数比为?。
(4)X和Y原子结合形成的X3Y4晶体,其晶体结构与金刚石类似,但硬度比金刚石大,其原因是?。
参考答案:(1)N>C>Na(2分)
(2)K、Cr(2分);Cu2++4NH3·H2O="==" [Cu(NH3)4 ]2++4H2O(2分)
(3)sp2(2分);4:1(2分)
(4)氮原子半径小于碳,氮碳形成的共价键键长更短,键能更大,键更稳定(2分)
本题解析:考查原子核外电子排布规律、元素周期律、化学键以及晶体类型的判断等。
根据①可知W是铜。根据②可知T是H。根据③可知X是C。金属性越强,第一电离能越小,所以根据⑤可知Q是Na。根据⑥可知R是Cl。Z的原子序数介于C和Na之间,所以根据④可知Z是O,Y的原子序数大于C的,小于O的,则Y只能是N。
(1)非金属性越强,电负性越大,因此是N>C>Na。
(2)根据构造原理可知铜原子的最外层电子数是1,在第四周期中满足最外层电子数为1的还有K和Cr。[Cu(NH3)4 ]2+是通过配位键形成的离子,所以反应的方程式为Cu2++4NH3·H2O="==" [Cu(NH3)4 ]2++4H2O。
(3)蚁酸的结构简式为HCOOH,结构式为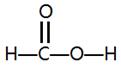 ,所以碳原子采取的是sp2杂化。因为双键是由1δ键个和1个π键组成的,所以该化合物中δ键和π键的个数之比是4:1。
,所以碳原子采取的是sp2杂化。因为双键是由1δ键个和1个π键组成的,所以该化合物中δ键和π键的个数之比是4:1。
(4)金刚石是原子晶体,所以C3N4晶体也是原子晶体。形成原子晶体的共价键越强,硬度越大。由于氮原子半径小于碳原子半径,所以碳和氮形成的共价键强于碳和碳形成的共价键,所以硬度更大。
本题难度:一般
2、填空题 下图是元素周期表的框架
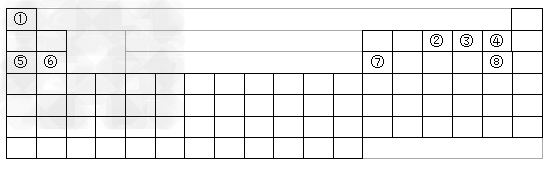
(1)请在上图中画出金属元素和非金属元素的分界线(线条必须明显)。
(2)依据上述元素周期表的框架中提供的信息回答下列问题(1、2、3用化学式表示):?
1)⑤和⑥两种元素的最高价氧化物的水化物碱性强弱顺序是? ;
2)写出由①、③、⑧三种元素形成的最简单化合物的电子式? ;
3)某元素的单质在常温下化学性质稳定,通常可作为化学反应保护气的是? ;
4)全部是金属元素的主族是? ,全部是非金属元素的主族是?。?
?a. ⅠA族?b. ⅡA族?c. ⅣA族? d. ⅦA族
(3)某元素是第三周期的金属元素,且其原子半径是同周期的金属中最小的,则该元素的单质与NaOH溶液反应的离子方程式是?。
参考答案:(1 )“略”
(2 ) 1 )NaOH >Mg(OH)2?
? 2 )?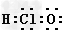 ?
?
? ?3 )N2?
? ?4 )b , d
(3 )2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
本题解析:
本题难度:一般
3、选择题 下列化合物中既有离子键又有共价键的是( )
A.KBr
B.NH4Cl
C.HF
D.O3
参考答案:B
本题解析:
本题难度:简单
4、选择题 下列说法中正确的是( )
A.已知冰的熔化热为6.0kJ?mol-1,冰中氢键键能为20kJ?mol-1.假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键
B.已知一定温度下,醋酸溶液的物质的量浓度为C,电离度为α,Kα=(Cα)2/C(1-α).若加入少量CH3COONa固体,则电离平衡CH3COOH≒CH3COO-+H+向左移动,α减小,Kα变小
C.实验测得环己烷(l)、环己烯(l)、和苯(l)的标准燃烧热分别为-3916kJ?mol-1、-3747kJ?mol-1和-3265kJ?mol-1,可以证明在苯分子中不存在独立的碳碳双键
D.已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=489.0kJ?mol-1CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1
C(石墨)+O2(g)=CO2(g)△H=-393.5kJ?mol-1则4Fe(s)+3O2(g)=2Fe2O3(s)△H=-1641.0kJ?mol-1
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列描述中正确的是
A.CS2为V形的极性分子
B.ClO3-的空间构型为平面三角形
C.SF6中的空间构型为正四面体形
D.SiF4和SO32-的中心原子均为sp3杂化
参考答案:D
本题解析:A、CS2为直线型的非极性分子,错误。B、ClO3-的空间构型为三棱锥型。错误。C、SF6中的空间构型为正八面体型。错误。D、SiF4和SO32-的中心原子均为sp3杂化。正确。
本题难度:一般