微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中,正确的是(? )
A.氢键只存在于同一种分子之间
B.金属阳离子只能与阴离子构成晶体
C.粒子间以分子间作用力结合的晶体,其熔点不会很高
D.氮化硅是一种新型的耐高温耐磨材料,它属于分子晶体
参考答案:C
本题解析:A项氢键可存在于不同分子之间,B项金属晶体中就只有金属阳离子与自由电子,无阴离子,C项以分子间作用力结合的晶体属分子晶体,其熔点不会很高,D项氮化硅属原子晶体,故只有C正确。
本题难度:简单
2、填空题 氮元素可以形成多种化合物。
回答以下问题:
(1)基态氮原子的价电子排布式是__________________。
(2)C、N、O三种元素第一电离能从大到小的顺许昌是_________________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①NH3分子的空间构型是____________;N2H4分子中氮原子轨道的杂化类型是____________________。
②肼可用作火箭燃料,燃烧时发生的反应是:
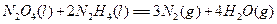 ?
?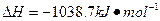
若该反应中有4mol N—H键断裂,则形成的 键有___________mol。
键有___________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________(填标号)
a.离子键? b.共价键? c.配位键? d.范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体得4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物是别的是________________(填标号)。
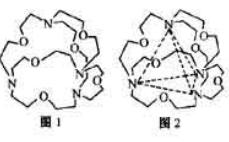
a.CF4? b. CH4? c. NH4+? d.H2O
参考答案:
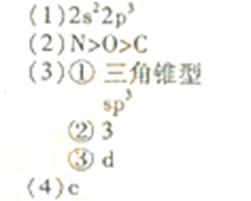
本题解析:略
本题难度:一般
3、选择题 以下说法正确的是?
A.白磷与金刚石一样,晶体中原子以共价键结合,形成空间网状结构
B.CO2和SiO2晶体中,化学键类型相同,晶体类型也相同
C.共价化合物可以含离子键
D.NH4Cl晶体中既含有离子键又含有共价键
参考答案:D
本题解析:A不正确,白磷是分子晶体,金刚石是原子晶体。B不正确,CO2是分子晶体。全部由共价键形成的化合物是共价化合物,所以共价化合物中不能含有离子键,C不正确。答案选D。
本题难度:简单
4、选择题 烃类分子中的碳原子与其他原子的结合方式是
[? ]
A.形成四对共用电子对
B.通过非极性键
C.通过两个共价键
D.通过离子键和共价键
参考答案:A
本题解析:
本题难度:简单
5、填空题 (16分)已知A、B、C、D、E、F六种元素的原子序数依次递增,都位于前四周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同。F处于周期表中第9列。
(1)B、C、D三种元素的氢化物的沸点高低顺序为?,稳定性顺序为?。
(2)同时含有A、B、D三种元素的化合物M是此类物质中为数不多的气体,且分子中所有原子共平面,则M中σ键和π键个数比为?,B原子的杂化类型为?,M能和水以任意比混溶的原因是?。
(3)C的最高价含氧酸根的空间构型为?,E的基态原子的价电子排布式为?
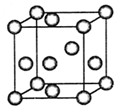
(4)“生物金属”E内部原子的堆积方式与铜相同,都是面心立方堆积方式,如图。则E晶胞中E的配位数为?,若该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,E原子的摩尔质量为M g/mol,则E原子的半径为?cm
(5)F可形成分子式均为F(NH3)5BrSO4的两种配合物,其中一种化学式为[F(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,产生的现象是?;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为?。
参考答案:(16分)(没作说明每空1分)
(1)CH4 < NH3< H2O ;CH4 < NH3< H2O
(2)3︰1;sp2杂化;甲醛能和水分子间形成氢键(2分)
(3)平面三角形(2分);3d24s2(2分)
(4)12;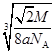 (2分)
(2分)
(5)产生白色沉淀;[Co(SO4)(NH3)5]Br(2分)
本题解析:A只能为氢元素;B为1s22s22p2,即为碳元素;而D为1s22s22p4,为氧元素,进而可推出C只能为氮元素;E为钛元素,F为钴元素
(1)B、C、D三种元素的非金属性依次增强,氢化物的稳定性也依次增强CH4 < NH3< H2O,而由于氨气、水中有氢键,氢化物沸点CH4 < NH3< H2O
(2)M为甲醛气体;其中的C原子sp2杂化,两个C—Hσ键、一个C—Oσ键和一个C—Oπ键;它与水可形成氢键,所以能与水与任意比互溶
(3)由NO3—的VSEPR模型可推出它为平面三角形空间结构
(4)E在三维面上的配位数共12个;
假设晶胞的连长为b,则 ,可知:b=
,可知:b=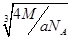 ,所以:
,所以:
E原子的半径为 ×
×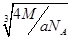 /4=
/4=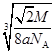
(5)[F(NH3)5Br]SO4,可电离出硫酸根离子,与BaCl2溶液混合时产生白色的硫酸钡沉淀,而[Co(SO4)(NH3)5]Br可电离出溴离子,与AgNO3溶液混合时产生溴化银淡黄色沉淀。
本题难度:一般