微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在氯化氢分子中,形成共价键的原子轨道是
[? ]
A.氯原子的2p轨道和氢原子的1s轨道
B.氯原子的2p轨道和氢原子的2p轨道
C.氯原子的3p轨道和氢原子的1s轨道
D.氯原子的3p轨道和氢原子的3p轨道
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列有关原子核外电子的说法错误的是( )
A.在含有多个电子的原子里,电子分别在能量不同的区域内运动
B.电子总是尽可能地先从内层排起,当一层充满后再填充下一层
C.每个电子层作为最外层时,最多可容纳8个电子
D.离原子核近的电子能量低,离原子核远的电子能量高
参考答案:C
本题解析:
本题难度:一般
3、填空题 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.
(1)基态Ni原子的价电子(外围电子)排布式为______;
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式______、______;
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应.如①CH2=CH2、②HC≡CH、③
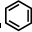
、④HCHO其中碳原子采取sp2杂化的分子有______(填物质序号),HCHO分子的立体结构为______形;
(4)Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO______FeO(填“<”或“>”);
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示.该合金的化学式为______;
(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图2所示.该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键.

参考答案:(1)核外电子排布为[Ar]3d84s2,则价电子排布式是3d84s2,故答案为:3d84s2;
(2)CO含有2个原子14个电子,所以CO互为等电子体的一种分子和一种离子的化学式为:N2、CN-(或O22+、C22-、NO+),故答案为:N2;CN-;
(3)①CH2=CH2中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
②HC≡CH中每个碳原子含有2个σ键,不含孤电子对,所以采取sp杂化,故错误;
③
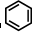
中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
④HCHO中碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
HCHO中碳原子含有3个σ键,不含孤电子对,所以其空间构型是平面三角形;
故答案为:①③④;?平面三角;?
(4)影响离子晶体熔点的因素有离子半径和电荷,相同电荷时,离子半径越小,熔点越高,镍离子半径小于亚铁离子半径,所以氧化镍熔点高于氧化亚铁熔点,
故答案为:>;
(5)该晶胞中含La原子个数=8×18=1,含有Ni=1+812=5,所以其化学式为LaNi5或Ni5La,故答案为:LaNi5或Ni5La;
(6)中心原子提供空轨道配体提供孤电子对形成配位键;氢键存在于已经与N、O、F等电负性很大的原子形成共价键的H与另外的N、O、F等电负性很大的原子之间,
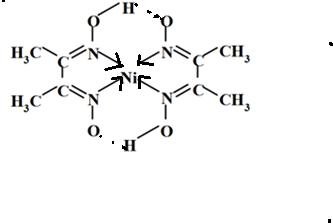
,故答案为:

.
本题解析:
本题难度:一般
4、选择题 如图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体.下列判断不正确的是( )
A.e、f单质晶体熔化时克服的是共价键
B.d单质对应元素原子的电子排布式:1s22s22p63s23p2
C.b元素形成的最高价含氧酸易与水分子之间形成氢键
D.单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含2个σ键,2个π键
