微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)已知硝酸锏溶液颜色为蓝色.某学校化学课外小组同学们在做铜与浓硝酸、稀硝酸反应的实验中,发现铜和浓硝酸反应后溶液为绿色旦有红棕色气体产生,而铜和稀硝酸反应后溶液为蓝色,产生无色气体.为弄清反应后溶液颜色出现差异的原因,他们进行了实验探究.
[实验]在两支试管中各放入一小块等质量的铜片,分别加人等体积的浓HN03(14 mol ?
L-1)和稀HN03(4mol . L-1 ), 立即用蘸有NaOH的棉花封住试管口。充分反应后铜均无剩余。
(1) Cu与浓HNO3反应的离子方程式________________________________
(2) 用蘸有NaOH的棉花封住试管口的原因________________
已知NO2与NaOH溶液反应中,其中NO2的还原产物是亚硝酸盐(NO2-)
写出反应的化学反应式________________________,
[提出假设]假设一、因为铜离子浓度大造成的。
假设二、溶液呈绿色是因为铜与浓硝酸反应时产生的二氧化氮溶于过量浓硝酸,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。
[设计实验方案,验证假设]
(3) 上述实验________(“能”或“不能”)证明假设一不成立,原因________________
(4) 甲同学设计实验验证假设二,请帮他完成下表中内容(提示:NO3-在不同条件下的还咬产物较复杂,有时难以观察到气体产生)

[分析推理】
(5)铜和稀硝酸反应后溶液为蓝色的原理________________
参考答案:(14分)

本题解析:略
本题难度:一般
2、选择题 下列有关实验操作错误的是( )
A.从碘水中提取碘可用萃取的方法
B.分离含Mg2+和Al3+的混合液,可加入过量NaOH溶液,然后过滤
C.NH4+的检验:加入NaOH溶液微热,再用湿润的蓝色石蕊试纸检验变红
D.用KSCN溶液可检验Fe3+离子
参考答案:A、从碘水中提取碘可以用本或是四氯化碳做萃取剂来进行萃取的方法,故A正确;
B、铝离子可以和过量的强碱反应生成偏铝酸盐可溶性的溶液,但是镁离子只会生成沉淀,然后过滤,即可以将含Mg2+和Al3+的混合液分离,故B正确;
C、铵盐可以和强碱反应生成具有刺激性气味的氨气,则NH4+的检验时先加入NaOH溶液微热,再用湿润的红色石蕊试纸检验变蓝,故C错误;
D、三价铁离子遇到硫氰酸根离子显示红色,可以用硫氰酸钾来检验铁离子,故D正确.
故选C.
本题解析:
本题难度:一般
3、简答题 过碳酸钠(2Na2CO3?3H2O2)是一种新型高效固体漂白杀菌剂,它具有无臭、无毒、无污染的特点,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,依托纯碱厂制备过碳酸钠可降低生产成本,其生产流程如下.
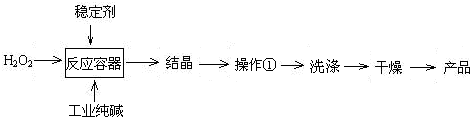
试回答下列问题:
(1)过碳酸钠溶于水后所得溶液一定显______(“酸性”、“碱性”或“中性”).
(2)操作①需要的玻璃仪器有______(填写仪器名称).
(3)工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量.
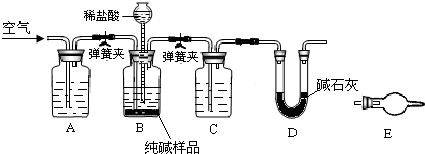
①要检验工业纯碱中杂质的存在,最好选用下列试剂中的______(选填序号).
A.氢氧化钡溶液?B.稀硝酸?C.硫氰化钾溶液?D.硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若______,说明装置不漏气.
③装置A的作用是______.装置C中的试剂为______.
④某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要?______(选填“必要”或“不必要”),判断的理由是______.
参考答案:(1)过碳酸钠溶于水后所得溶液,在水溶液中能解离成过氧化氢与碳酸钠,过氧化氢溶液是极弱的弱酸,而碳酸钠在水中由于水解会显示碱性,故答案为:碱性;
(2)操作①是过滤分离固体和溶液,过滤装置需要的玻璃仪器为漏斗、烧杯、玻璃棒,故答案为:普通漏斗、烧杯、玻璃棒;
(3)①纯碱中常含有少量NaCl,用检验氯离子的方法进行检验,需要试剂为硝酸银和稀硝酸,
A.氢氧化钡溶液 不能检验氯离子存在,故A不选;
B.稀硝酸 验证生成的氯化银不溶,故B选;
C.硫氰化钾溶液是检验铁离子的存在,不能检验氯离子,故C不选;
D.硝酸银溶液和氯离子反应生成白色沉淀,加入稀硝酸不溶证明含有氯离子,故D选;
故答案为:BD;
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,利用压强变化和液面变化分析判断,若漏斗中与试剂瓶中的液面差保持不再变化,证明装置气密性完好,
故答案为:漏斗中与试剂瓶中的液面差保持不再变化或漏斗中的液面不再下降;
③装置A是为了吸收空气中二氧化碳,避免影响碳酸钠含量的测定;装置C是浓硫酸干燥生成的二氧化碳气体,在D装置中吸收后称量至恒重,
故答案为:除去空气中CO2,防止影响测量结果;浓硫酸;
④U性管是吸收二氧化碳气体称重来测定碳酸钠含量的方法,若与空气直接接通,会吸收空气中二氧化碳和水蒸气测定结果偏高,影响测定结果的准确性,
故答案为:必要;因为装置E会吸收空气中的二氧化碳和水蒸气,影响测量结果.
本题解析:
本题难度:一般
4、选择题 下列实验操作中错误的是?(?)
A.蒸发时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取时,溶剂要互不相溶,溶质在两种溶剂中的溶解度相差很大
参考答案:A
本题解析:略
本题难度:简单
5、填空题 类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成 Fe ( NO3)3、,但当铁过量时,产物是 Fe ( NO3 ) 2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 C12足量时生成 FeC13 , 当铁粉过量时产物是 FeCl2。为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的 C12中点燃,取其表面生成物并分别编号为 A、B ,然后通过实验确定其成分。探究过程如下:
( 1 )提出假设: A 是 FeCl3, B 是 FeCl 2。
( 2 )设计实验方案:分别取 A、B 的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。

( 3 )根据上述实验结论,写出 C12与铁粉加热时发生反应的化学方程式:
_________________________________________________________________。
( 4 )为进一步探究 FeC13溶液的性质,他又利用 A 溶液做了如下一些实验,其中明显错误的是____________________。
A.将 A 溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.向 A 溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在 A 溶液中滴加 Na OH 浓溶液,出现红褐色沉淀
D.将 A 溶液加热蒸干并灼烧,得到 FeC13固体
( 5 )实际应用:
FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有 FeC13、FeCl2、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收 Cu的方案:
方案1:向废液中加人过量的铁粉,充分反应后,过滤。在所得滤渣中加人足量的盐酸,充分反后,再过滤即得到铜。方案1 中涉及的四种阳离子的氧化性由强到弱的顺序为:
_____________________________________。
方案2 :在废液中加人适量的盐酸调节溶液的 pH =" 1" ,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的 Cu 已全部析出。方案 2 中铜作_________极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)___________________________________________________
方案 2 在电极上直接回收铜,操作上比方案 1 简便,但方案 2 也有不足之处,主要表现为:_____________________________________________________。
参考答案:(2)溶液变红色(1分) FeCl2 ( 1 分) ( 3 ) 2Fe十3Cl2 2FeCl3 ( l 分)
2FeCl3 ( l 分)
( 4 ) BD (2分) ( 5 )方案 1 : Fe3+ >Cu2+ > H + > Fe2+ ( l 分)
方案 2 :阴( l 分)2Fe 3++2e一=2Fe2+ ;
Cu2+ + 2e一=Cu ( l 分);
2H + + 2e一=H2↑; ( l 分)
①污染性气体 C12产生( l 分)②使用了电解装置,成本较高等。( l 分)
本题解析:Fe3+遇SCN一变红色。 Fe2+能使 KMnO4溶液褪色; FeC13溶液加人铁粉,将三价铁还原为二价铁,颜色变浅; FeC13溶液加热蒸干最后得到的是三氧化二铁, ( 5 )向废液中加人过量的铁粉,铁粉首先和三价铁离子反应,将其转化为二价铁离子,然后和铜离子反应,再加人盐酸,盐酸和过量的铁粉反应生成二价铁离子,由此知四种离子的氧化性由强到弱的顺序为Fe3+ >Cu2+ > H+ >Fe2+,方案 2 中用铜作阴极,电极上的反应为2Fe3++2e一=2Fe2+,然后 Cu2++2e一=Cu , 2H+十2e一=H 2↑ , 不足之处,阳极会产生氯气污染,会消耗大量的电能等。
本题难度:一般