|
高考化学试题《无机综合与推断》高频考点巩固(2017年模拟版)(二)
2017-08-10 00:32:10
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据下列框图,有关说法正确的是

A.M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱
B.反应⑤的离子方程式可表示为:2E(OH)3 +3Cl2 +6H2O =3EO4 2―+ 6Cl― +12H+
C.反应①、②、③、⑤都属于氧化还原反应,且在反应①和③中硫酸仅表现了酸性
D.用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为:
| EO42―+4H2O+3e-=E(OH)3+5OH―
参考答案:C
本题解析:流程分析可知,M为铜,在酸性溶液中被过氧化氢氧化为铜盐溶液CuSO4,依据Y加入KSCN溶液血红色说明是Fe3+离子,和氨水反应生成红褐色沉淀氢氧化铁;说明X为亚铁离子形成的硫酸亚铁溶液,推断E为Fe,则X为FeSO4,Y为Fe2(FeSO4)3,Z为Fe(OH)3,A、Fe2+的氧化性比Cu2+的氧化性弱,但Fe3+的氧化性比Cu2+强,如2Fe3++Cu═2Fe2++Cu2+,故A错误;B、Fe(OH)3可被氯气氧化生成高铁酸钾,反应在碱性条件下进行,不可能生成H+,应为2E(OH)3+3Cl2+12OH-=3EO42-+6Cl-+6H2O,故B错误;C、①②⑤都有单质参加反应,③有过氧化氢参加反应,则一定为氧化还原反应,①和③中硫酸都只表现了酸性,表现氧化性的为过氧化氢,故C正确;D、负极发生氧化反应,应是锌失电子被氧化,故D错误,答案选C。
本题难度:一般
2、填空题 现有常见金属单质A和气体甲、乙及物质B、C、D、E、F,它们之间能发生如下反应,已知B加入硫氰化钾溶液显血红色,气体乙显红棕色,(图中有些反应的产物和反应的条件没有全部标出).
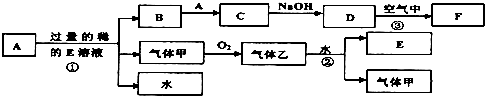
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A______,C______
(2)写出反应①的化学方程式______;
(3)写出反应②的化学方程式______;
(4)B物质的阳离子用于制作印刷电路板的原理是(用离子方程式表示)______
(5)缺铁性贫血患者应补充C物质的阳离子,而B物质的阳离子则无这种药效.当用C物质的阳离子制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是______如果药片已经失效,应如何检验?写出主要操作与现象:______.
参考答案:依据转化关系分析可知,已知B加入硫氰化钾溶液显血红色,证明含铁离子,气体乙显红棕色证明为NO2,气体甲为NO,E为HNO3,金属单质A为Fe;B为Fe(NO3)3,C为Fe(NO3)2,D为Fe(OH)2,F为Fe(OH)3;
(1)A、C的化学式分别为:Fe、Fe(NO3)2,故答案为:Fe;Fe(NO3)2;
(2)反应①是铁和稀硝酸反应生成硝酸铁、一氧化氮和水的反应,反应的化学方程式为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,
故答案为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O;
(3)反应②是二氧化氮和水的反应,反应的化学方程式为:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(4)B为Fe(NO3)2物质的阳离子为Fe3+用于制作印刷电路板的原理是铁离子和铜反应,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(5)铁性贫血患者应补充C物质的阳离子,而B物质的阳离子则无这种药效.当用C物质的阳离子制成药片时外表包有一层特殊的糖衣,亚铁离子具有还原性,易被氧化,糖衣是为了避免亚铁离子被氧化;如果药片已经失效可以根据铁离子检验方法进行检验,FeSO4易被空气中的氧气氧化,被氧化生成Fe3+离子,可用KSCN溶液检验,实验操作为取少量研碎的药片放入试管中,加适量的水溶解,然后滴加数滴KSCN溶液,反应后溶液显红色,则表明该药片已部分或全部失效,
故答案为:保护FeSO4不被空气中的氧气氧化;取少量研碎的药片放入试管中,加适量的水溶解,然后滴加数滴KSCN溶液,反应后溶液显红色,则表明该药片已部分或全部失效.
本题解析:
本题难度:一般
3、填空题 如图物质的转化关系中,A是一种固体单质,E是一种白色沉淀.据图填写.
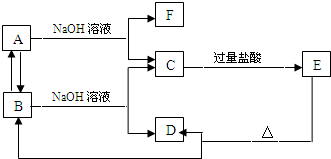
(1)B的化学式是______
(2)B和NaOH溶液反应的离子方程式是______
(3)C和过量盐酸反应的离子方程式是______
(4)B→A反应的化学方程式______.
参考答案:A是一种固体单质,能和氢氧化钠溶液反应,则A可能是铝或硅,铝、硅分别和氢氧化钠溶液反应分别生成偏铝酸钠、硅酸钠,偏铝酸钠和过量盐酸反应生成可溶性的氯化铝,硅酸钠和过量盐酸反应生成难溶性的硅酸,所以E是H2SiO3,根据元素守恒知,A是Si,C是Na2SiO3,F为H2,加热硅酸生成二氧化硅和水,二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,则D为H2O,B为SiO2,
(1)通过以上分析知,B是二氧化硅,B的化学式是SiO2,故答案为:SiO2;
(2)B是二氧化硅,二氧化硅属于酸性氧化物,能和氢氧化钠溶液反应生成硅酸钠和水,离子方程式为:SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(3)C是硅酸钠,硅酸钠和过量盐酸反应生成硅酸沉淀,离子反应方程式为:SiO32-+2H+=H2SiO3↓,
故答案为:SiO32-+2H+=H2SiO3↓;
(4)在高温下,二氧化硅和碳反应生成硅和一氧化碳,反应方程式为:SiO2+2C高温.2CO↑+Si,
故答案为:SiO2+2C高温.2CO↑+Si.
本题解析:
本题难度:一般
4、选择题 甲、乙为短周期同一主族元素组成的单质,丙、丁为氧化物,它们存在如下转化关系,则满足条件的甲和乙分别为(?)
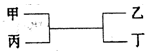 ? ?
A.铝和铁
B.碳和硅
C.镁和碳
D.氢气和钠
参考答案:B
本题解析:
正确答案:B
A、铁是副族元素;B、正确,2C+SiO2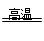 Si+2CO;C、不正确,镁和碳不是同一主族元素;D、2Na+2H2O=2NaOH+H2↑NaOH不是氧化物。 Si+2CO;C、不正确,镁和碳不是同一主族元素;D、2Na+2H2O=2NaOH+H2↑NaOH不是氧化物。
本题难度:一般
5、填空题 (13分)A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空:
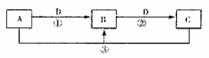
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是?;工业上制取A的离子方程式为?。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为?。
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是?。
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,则反应③的化学方程式?。
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
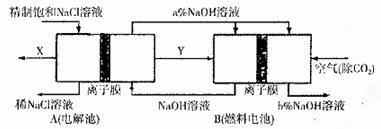
①图中X、Y分别是?、?(填化学式),分析比较图示中氢氧化钠质量分数a%?b%(填“>”、“=”或“<”)
②写出燃料电池B中负极上发生的电极反应?。
参考答案:
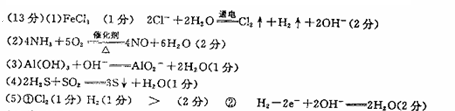
本题解析:略
本题难度:一般
|