微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性.下述为相关实验步骤和实验现象:

请回答:
(1)写出A、B和C的化学式:A______,B______,C______;
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:______,______;
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:______;
(4)写出由F→H的化学方程式:______.
参考答案:钠盐A能和AgNO3溶液反应生成一种难溶于HNO3的黄色沉淀,可确定A为NaI,C为AgI;黄绿色气体F是Cl2;F和NaOH溶液反应生成钠盐B,根据B呈碱性并具有氧化性,可知B为NaClO(NaCl、NaClO3溶液均呈中性);NaClO具有强氧化性,能氧化NaI,少量NaClO将NaI氧化成I2,进一步反应生成NaIO3,其中I为+5价;Cl2氧化FeCl2生成FeCl3,FeCl3又能氧化SO2生成SO42-,则
(1)由以上分析可知A为NaI,B为NaClO,C为AgI,故答案为:NaI;?NaClO;?AgI;
(2)NaClO具有强氧化性,能氧化NaI,少量NaClO将NaI氧化成I2,反应的离子方程式为2I-+ClO-+H2O=I2+Cl-+2OH-,
进一步反应可把I2氧化为NaIO3,反应的离子方程式为I2+5ClO-+2OH-=2IO3-+5Cl-+H2O,
故答案为:2I-+ClO-+H2O=I2+Cl-+2OH-;?I2+5ClO-+2OH-=2IO3-+5Cl-+H2O;
(3)FeCl3能氧化SO2生成SO42-,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(4)F→H为Cl2与NaOH的反应,反应的方程式为Cl2+2NaOH=NaClO+NaCl+H2O,故答案为:Cl2+2NaOH=NaClO+NaCl+H2O.
本题解析:
本题难度:一般
2、实验题 (7分)研究某一化学反应的实验装置右如下图所示:A~F属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氯水、水、锌粒、铜片、食盐、高锰酸钾、氯化钙、氧化钙、四氧化三铁、氧化铁、氧化铜、氢气、二氧化碳、二氧化氮、一氧化碳、氯气、氯化氢、氨气、氮气、氧气。实验现象;①D物质由黑色变为红色②无水硫酸铜粉末放入无色透明的E中得到蓝色溶液③点燃的镁条伸入无色无味的F中镁条表面生成一种固体物质。将该物质放入水中,有气体放出,该气体具有刺激性气味。并能使润湿的红色石蕊试纸变蓝。通过分析回答:
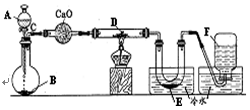
(1)写出A~F的物质名称:A.?,B.?, E.?,
(2)写出有关的化学方程式: C与D?;
F与Mg的反应产物与水?。
参考答案:(1)写出A~F的物质名称:A.浓氨水,B.氧化钙,E.水,。(各1分)
(2)写出有关的化学方程式: C与D:2NH3+3CuO△==3Cu+N2+3H2O;(2分)
F与Mg的反应产物与水:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑。(2分)
本题解析:略
本题难度:一般
3、简答题 下图中A是一种无色液体,G是一种极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应5是工业制X的主要反应之一.
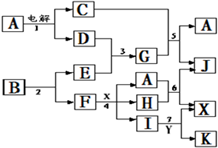
请按要求填空:
(1)写出下列物质的化学式
A?、E?、F?、K?;
(2)写出反应5的化学方程式?
(3)1molB通过反应2得到1molF,B中F的质量分数为72%,则B的化学式为?.
(4)写出反应4的离子方程式?.
参考答案:A是一种无色液体,A为H2O,G是一种极易溶于水的碱性气体,则G为NH3,由转化关系图可知,C为O2,D为H2,则E为N2,Y是胃酸的主要成分,Y为HCl,K是不溶于稀硝酸的白色沉淀,K为AgCl,反应5是工业制X的主要反应之一,则X为硝酸,反应5为氨气的催化氧化反应,再结合转化关系图可知,F为Ag,所以B中含有Ag、N两种元素,反应4为Ag与硝酸的反应,(1)由上述推断可知A为H2O,E为N2,F为Ag,K为AgCl,故答案为:H2O;N2;Ag;AgCl;
(2)反应5为氨气的催化氧化反应,氨气与氧气反应生成一氧化氮和水,反应的方程式为4NH3+5O2催化剂.△4NO+6H2O,
故答案为:4NH3+5O2催化剂.△4NO+6H2O;
(3)1molB通过反应2得到1molF,设B的化学式为AgNx,则108108+14x×100%=72%,解得x=3,所以B的化学式为AgN3,故答案为:AgN3;?
(4)反应4为Ag与硝酸的反应,结合反应6可知,Ag与硝酸反应生成NO2,离子反应为Ag+2H++NO3-═Ag++NO2↑+H2O,故答案为:Ag+2H++NO3-═Ag++NO2↑+H2O.
本题解析:
本题难度:一般
4、填空题 A是废铁屑表面上红棕色固体铁锈的主要成分,B、C、F都是单质,D、F都是无色无味的气体,它们之间的相互转化关系如下图:

试写出下列各物质的化学式:
A.______?B.______?C.______?D.______?E.______?G.______.
参考答案:A是废铁屑表面上红棕色固体铁锈的主要成分,说明A是Fe2O3.可在高温下与单质B反应生成单质C和气体D,说明这个置换反应是具有强还原性的碳参与的,不是铝热反应(生成两种固体),因为D能与过量石灰水反应生成白色沉淀,说明D是CO2,白色沉淀E是碳酸钙.固体C是Fe,与硫酸反应生成的气体F是H2,浅绿色溶液是FeSO4溶液.
故答案为:Fe2O3 ;C;Fe;CO2 ;CaCO3;FeSO4.
本题解析:
本题难度:一般
5、填空题 在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂,F是地壳中含量最多的金属元素。(反应中生成的水和部分反应条件未列出)
 ?
?
(1)画出A中阴离子的结构示意图?。
(2)反应②在点燃条件下的现象是?。
(3)H转化为F的氢氧化物最好选择的试剂是?。
(4)反应③的离子方程式为?。
(5)反应④的离子方程式为?。
参考答案:(1)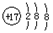 ?(2分)?
?(2分)?
(2)安静燃烧、苍白色火焰、产生白雾(2分答出两点即可)
(3) CO2(2分)?
(4)Cl2+2OH-=Cl-+ ClO- + H2O(2分)
(5)2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
本题解析:根据信息分析A、B、C、D、E、F、G、H分别为NaCl、H2O、H2、Cl2、NaOH、Al、NaClO、NaAlO2、HCl。(2)氢气在氯气中安静的燃烧,发出苍白色火焰,在火焰上方产生白雾;(3)应为氢氧化铝两性,能与强碱强酸反应,故实现由偏氯酸钠到氢氧化铝的转化应用弱酸,一般用二氧化碳。
本题难度:一般