| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《热化学方程式》高频试题预测(2017年最新版)(六)
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g) ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。 CH3OH(g) ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。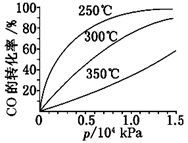 该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是______________________ 。 参考答案:(1)3NO2+H2O=2HNO3+NO(2分) 6.72(2分) 本题解析:(1)NO2溶于水生成硝酸和NO,反应的化学反应方程式为3NO2+H2O=2HNO3+NO。在反应6NO2+8NH3 本题难度:困难 3、填空题 (12分)2SO2(g)+O2(g) 参考答案:(1)放热 (2)生成物的总能量 (3) 形成新键释放的能量 本题解析:图像先看清横纵轴:横轴表反应过程,纵轴表物质的能量 本题难度:一般 4、填空题 用CH4催化还原NOx可以消除氮氧化物的污染.例如: 参考答案:已知①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1,②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ?mol-1, 本题解析: 本题难度:一般 5、简答题 在恒温恒容的密闭容器中通入lmoIN2和XmolH2,发生如下反应:N2(g)+3H2(g) 已知:①反应过程能量变化如右图;②达到平衡时,测得反应放出的热量为18.4KJ,混合气体物质的量为3.6moL,容器内压强减小10%; 请回答下列问题: (1)图中A点表示______;C点表示______; (2)该反应通常使用铁为主体的复合催化剂,使用该催化剂时,B点的变化是______(填“升高”或“降低”) (3)X值为______; (4)该反应的热化学方程为______; (5)若起始时充入的N2、H2、NH3物质的量分别为a、b、c,平衡时各组分的量与上述平衡均相等,且始终维持反应向正方向进行,则起始时c的取值范围为______. 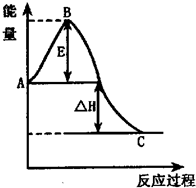 参考答案:(1)从能量变化图可知,A点代表反应物具有的总能量,C点代表生成物具有的总能量,故答案为:反应物具有的总能量? 生成物具有的总能量; 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《中和滴定实.. | |