微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 反应mA(s)+nB(g) pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
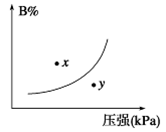
A.n>p
B.x点表示的正反应速率小于逆反应速率
C.x点比y点时的反应速率慢
D.若升高温度,该反应的平衡常数增大
参考答案:C
本题解析:根据图像可知,随着压强的增大,B的含量增大。这说明增大压强平衡逆反应方向进行,所以n小于p,选项A不正确;x点要达到平衡状态,则应该保持压强不变,此时B的含量是减小的,因此反应向正反应方向进行,即正反应速率大于逆反应速率,选项B不正确;y点压强高于x点压强,所以y点反应速率大于x点反应速率,选项C正确;升高温度平衡向逆反应方向进行,平衡常数减小,选项D不正确,答案选C。
本题难度:一般
2、选择题 向5 mL 0.1 mol·L-1的KI溶液中滴加5~6滴0.1 mol·L-1的FeCl3溶液后,再进行下列实验,其中可证明FeCl3溶液和KI溶液的反应是可逆反应的实验是
A.再滴加AgNO3溶液,观察是否有AgI沉淀产生
B.加入CCl4振荡后,观察下层液体颜色
C.加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生
D.加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色
参考答案:D
本题解析:从所加试剂的量可知I—过量,理论上Fe3+将不会存在,所以加入CCl4振荡后,取上层清液,滴加KSCN溶液仍然能呈现血红色则可证明还有Fe3+的存在,原反应是可逆反应。
本题难度:一般
3、选择题 能用勒夏特列原理解释的是(?)?
A.红棕色的NO2,加压后颜色先变深后变浅
B.工业上合成NH3反应使用催化剂
C.实验室可以采用排饱和食盐水收集Cl2
D.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
参考答案:AC
本题解析:在其它条件不变时,改变影响平衡的一个条件,平衡就向能减弱这种改变的方向进行,这就是勒夏特列原理。在NO2中存在平衡2NO2 N2O4,增大压强平衡向正反应方向移动,所以A正确。催化剂不能改变平衡状态,不能用勒夏特列原理解释。饱和食盐水中氯离子的浓度大,能抑制氯气的溶解,正确。D中的可逆反应是反应前后体积不变的,所以改变压强,平衡不移动,不能用勒夏特列原理解释。答案是AC。
N2O4,增大压强平衡向正反应方向移动,所以A正确。催化剂不能改变平衡状态,不能用勒夏特列原理解释。饱和食盐水中氯离子的浓度大,能抑制氯气的溶解,正确。D中的可逆反应是反应前后体积不变的,所以改变压强,平衡不移动,不能用勒夏特列原理解释。答案是AC。
本题难度:简单
4、填空题 (10分)硫酸是工业生产中最为重要的产品之一。在催化反应室里进行的反应为:
2SO2(g)+O2(g) 2SO3(g)?ΔH=" –196.6" kJ·mol-1
2SO3(g)?ΔH=" –196.6" kJ·mol-1
(1)该反应发生的条件通常是400~500℃、?和?。
(2)SO3在?(填设备名称)中用?(填试剂名称)吸收。
(3)研究SO2 、NO2、CO等大气污染气体的处理具有重要意义。
已知: 2NO(g)+O2(g) 2NO2(g)?ΔH=" –113.0" kJ·mol-1
2NO2(g)?ΔH=" –113.0" kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=?kJ·mol-1。
SO3(g)+NO(g)的ΔH=?kJ·mol-1。
一定条件下,将NO2与SO2以物质的量之比1:2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是?。
a.体系压强保持不变?
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变?
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2的物质的量之比为1:6,则平衡常数K=?。
参考答案:(10分)(1)常压?催化剂(每空1分)
(2)吸收塔? 98%硫酸(每空1分)
(3)–41.8? b? 2.67或8/3(每空2分)
本题解析:略
本题难度:一般
5、选择题 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
| X
| Y
| Z
|
初始浓度/mol·L-1
| 0.1
| 0.2
| 0
|
平衡浓度/mol·L-1
| 0.05
| 0.05
| 0.1
|

 下列说法正确的是:
下列说法正确的是:
 A.反应达到平衡时,X的转化率为60%
A.反应达到平衡时,X的转化率为60%
 B.反应可表示为X+3Y
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
 C.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
 D.改变温度可以改变此反应的平衡常数
D.改变温度可以改变此反应的平衡常数
参考答案:BD
本题解析:反应中X消耗了0.05mol·L-1Y消耗了0.15mol·L-1Z生成了0.1mol·L-1, X的转化率为50%,A错误。反应可表示为X+3Y 2Z,其平衡常数为1600,B正确。增大压强使平衡向正反应方向移动,温度不变,平衡常数不变,C错误。
2Z,其平衡常数为1600,B正确。增大压强使平衡向正反应方向移动,温度不变,平衡常数不变,C错误。
本题难度:简单