微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
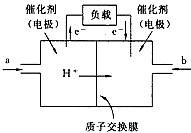
1、选择题 下图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂的作用下提供质 子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:
2CH3OH+ 3O2=2CO2+4H2O。下列说法正确的是
[? ]
A.左边的电极为电池的负极,a处通入的是甲醇
B.右边的电极为电池的负极,b处通入的是空气
C.电池负极的反应式为:CH3OH+H2O-6e-=CO2+6H+
D.电池正极的反应式为:O2+2H2O+4e-=4OH-
2、选择题 关于化学电源的叙述,错误的是
[? ]
A.化学电源均是根据原电池的工作原理设计的
B.在干电池中,碳棒只起导电作用,并不参加化学反应
C.镍镉电池不能随意丢弃的原因是镍、镉的资源有限,价格昂贵
D.燃料电池是一种高效、环保的新型化学电源
3、选择题 我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应式为:4Al+3O2+6H2O═4Al(OH)3下列说法不正确的是( )
A.电池工作时,电流由铝电极沿导线流向铂电极
B.正极反应式为:O2+2H2O+4e-═4OH-
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
4、选择题 (10分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)利用反应6NO2+ 8NH3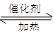 7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g)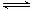 2SO3(g) ΔH=—196.6 kJ·mol-1
2SO3(g) ΔH=—196.6 kJ·mol-1
2NO(g)+O2(g)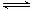 2NO2(g) ΔH=—113.0 kJ·mol-1
2NO2(g) ΔH=—113.0 kJ·mol-1
则反应NO2(g)+SO2(g)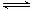 SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
(3)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O= Fe(OH)2+2Ni(OH)2
当电池放电时,正极电极反应式为 。
5、填空题 氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。氨的水溶液中存在电离平衡,常用电离常数Kb和电离度α来定量表示其电离程度。Kb和α常用的测定方法:在一定温度时用酸度计测定一系列已知浓度氨水的pH,可得各浓度氨水对应的c(OH-),然后通过换算求得各对应的α值和Kb值。下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1氨水
【实验数据】(不必填表格)
烧杯号
| V氨水 (mL)
| V水(mL)
| c (NH3·H2O)(mol·L-1)
| c(OH-)
| Kb
| α
|
1
| 50.00
| 0.00
| ?
| 1.34×10-3
| ?
| ?
|
2
| 25.00
| 25.00
| ?
| 9.48×10-4
| ?
| ?
|
3
| 5.00
| 45.00
| ?
| 4.24×10-4
| ?
| ?
|
请根据以上信息回答下述问题:?
(1)25℃时,氨水的电离常数:Kb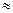 ?▲?,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系?▲??。
?▲?,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系?▲??。
(2)用0.10mol·L—1盐酸分别滴定20.00mL0.10mol·L—1的NaOH溶液和20.00mL0.10mol·L—1
氨水所得的滴定曲线如下:
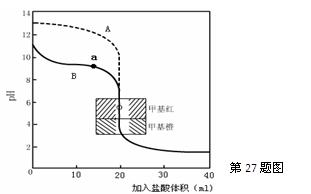
请指出盐酸滴定氨水的曲线为?▲?(填A或B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序?▲?。
(3)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有:
4NH3(g)+3O2(g)= 2N2(g)+6H2O(l)?△H1?①
4NH3(g)+5O2(g)= 4NO(g)+6H2O(l)?△H2?②
4NH3(g)+6NO(g)= 5N2(g)+6H2O(l)?△H3?③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1=?▲?。
(4)Allis-Chalmers制造公司发现可以用氨作为燃料电池的燃料。其总反应式为4NH3+3O2= 2N2+6H2O,正极上的电极反应式为O2+2H2O+4e—=4OH—,则负极上的电极反应式为?▲?。