| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《常见的化学电源》高频试题巩固(2017年最新版)(八)
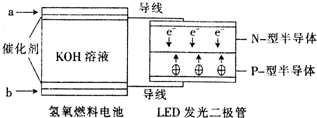 参考答案:A、由电子流向可知a为负极,b为正极,氢氧燃料电池中OH-向负极即向a极移动,故A错误; 本题解析: 本题难度:一般 4、填空题 (15分)如图所示的装置,X、Y都是惰性电极。将电路接通后,向(乙)中滴人酚酞溶液,在Fe极附近显红色。试回答下列问题: 参考答案:(1)CH4O2+2H2O+4e-=4OH-(2)氧化2Cl-+2H2O 本题解析:(1)因为甲为原电池,乙为电解池,因为铁电极附近显红色,说明是溶液中的氢离子放点,铁电极为阴极,则甲中a极为负极,甲烷在负极反应。B为原电池的正极,氧气得到电子生成了氢氧根离子,电极反应为:O2+2H2O+4e-=4OH-。(2)乙中石墨为电解池的阳极,发生氧化反应,乙中是电解氯化钠生成氢氧化钠和氯气和氢气,离子方程式为:2Cl-+2H2O 本题难度:困难 5、选择题 镍镉电池在现代生活中有广泛应用,它的充放电反应按下式进行: |
参考答案:C
本题解析:放电时负极发生氧化反应,则元素的化合价升高,根据所给的化学方程式判断,放电时,Cd元素的化合价升高,所以放电时的负极材料是Cd,答案选C。
考点:考查对电极材料的判断
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《烷烃》试题特训(2.. | |