微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 升高温度时,化学反应速率加快,主要是由于( )
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多,化学反应速率加快
C.该化学反应的过程是吸热的
D.该化学反应的过程是放热的
2、实验题 “碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表
实验编号
①
②
③
④
⑤
c(I-)/mol·L-1
0.040
0.080
0.080
0.160
0.120
c(SO42-)/mol·L-1
0.040
0.040
0.080
0.020
0.040
t /s
88.0
44.0
22.0
44.0
t2
回答下列问题:
(1)该实验的目的是_______________________。
(2)显色时间t2=_____________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为_____________(填字母)
A <22.0s B 22.0~44.0s C >44.0s D 数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是__________________________
3、选择题 下列说法不正确的是
[? ]
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应C(s) +CO2(g)=2CO(g)不能自发进行,则该反应的△H >O
C. 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱
4、选择题 足量的Fe粉与一定量的盐酸反应,为了减慢反应速率,但又不影响产生氢气的总量,应加入下列物质中的( )
A.NaNO3溶液
B.NaCl固体
C.Na2SO4溶液
D.CuSO4粉末
5、计算题 可逆反应C(s)+H2O(g)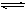 CO(g)+H2(g);△H=-Q。达到平衡后,改变温度使平衡发生移动,气体的平均相对分子质量如何变化?
CO(g)+H2(g);△H=-Q。达到平衡后,改变温度使平衡发生移动,气体的平均相对分子质量如何变化?