微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 将等物质的量的A,B混合于2L的密闭容器中,发生反应:3A(g)+B(g) xC(g)+2D(g)? ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)
xC(g)+2D(g)? ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)
(l)x的值为_______________;
(2)A的平衡浓度____________;
(3)若恒温恒容,则容器中平衡时的压强与起始时的压强比___________;
(4)下图是某一时间段中该反应速率与反应进程的曲线关系图,回答下列问题:
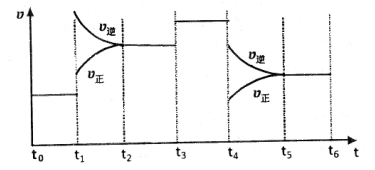
①处于平衡状态的时间段是____________。
②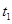 、
、 、
、 时刻体系中分别是什么条件发生了变化?
时刻体系中分别是什么条件发生了变化?
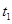 ___________、
___________、 _____________ 、
_____________ 、 _____________(填A-E)
_____________(填A-E)
A.升温? B.降温 ?C.加催化剂? D.加压?E.减压
③下列各时间段时,A的体积分数最高的是____
A.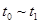 ? B.
? B.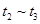 ? C.
? C.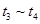 ? D.
? D.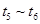
2、选择题 下表中是各组反应的反应物和温度,反应刚开始时,放出H2速率最快的是
[? ]
金属(粉末状)物质的量(mol) 酸的浓度及体积 反应温度(℃)
A. Mg,0.1 8mol·L-1,硝酸10mL 60
B. Mg,0.1 3mol·L-1,盐酸10mL 60
C. Fe,0.1 3mol·L-1,盐酸10mL 60
D. Mg,0.1 3mol·L-1,硫酸10mL 60
3、选择题 下列说法错误的是( )
A.食物放在冰箱中会减慢食物变质的速率
B.钾的金属性强,所以钾与水的反应比钠的反应剧烈
C.2molSO2与1molO2混合反应后一定能生成2molSO3
D.面粉厂严禁烟火的原因是面粉粉尘表面积大,与空气接触遇明火极易发生爆炸
4、实验题 (10分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1) 定性分析:如图甲可通过观察____________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________________________________________________________,
写出H2O2在二氧化锰作用下发生反应的化学方程式
____________________________________________________________________。
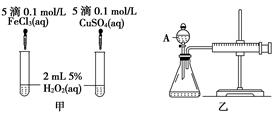
(2) 定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是___________________________________________________________。
检查乙装置气密性的方法是
____________________________________________________________________。
(3) 0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,发生如下反应:
2X(g)+Y(g)===nZ(g)+2W(g), 2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的反应速率为0.1 mol/(L·min),则前2 min内,用X的物质的量浓度变化表示的平均反应速率为________;2 min末时Y的物质的量浓度为________;化学方程式中,Z的化学计量数n=________。
(4) 在一定温度下,反应:2A(s)+2B(g) 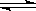 ?C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
?C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
A.容器内的压强不随时间而变化
B.混合气的密度不再随时间而变化
C.A的质量不再改变
D.平衡混合气体的平均相对分子质量不再改变
5、选择题 已知可逆反应2SO2+O2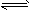 2SO3是放热反应,下列说法正确的是
2SO3是放热反应,下列说法正确的是
[? ]
A.2molSO2与1molO2能完全反应生成2molSO3,升高温度可以加快此反应的化学反应速率
B.2molSO2与1molO2不能完全反应生成2molSO3,升高温度可以加快此反应的化学反应速率
C.2molSO2与1molO2能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率
D.2molSO2与1molO2不能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率