微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列事实不能用勒夏特列原理解释的是
A.温度控制在500℃有利于合成氨反应
B.实验室中常用排饱和食盐水的方法收集Cl2
C.将相同体积、相同pH盐酸与醋酸分别稀释相同倍数,后者的pH变化值小于前者
D.打开碳酸饮料会有大量气泡冒出
参考答案:A
本题解析:如果改变影响平衡的1个条件,则平衡就向能够减弱这种改变的方向移动,这就是勒夏特列原理。合成氨是放热反应,所以高温是不利于平衡向正反应方向移动的,因此选项A不能用勒夏特列原理解释,其余选项都可以用勒夏特列原理解释。所以答案选A。
本题难度:一般
2、选择题 氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是
A.再通入少量氯气,c(H+)/c(ClO-)减小
B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量固体NaOH,溶液的pH会略微增大
参考答案:D
本题解析:略
本题难度:一般
3、选择题 将等物质的量的N2、H2气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:N2(g)+3H2 (g) 2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
?
| 改变条件
| 新平衡与原平衡比较
|
A
| 增大压强
| N2的浓度一定变小
|
B
| 升高温度
| N2的转化率变小
|
C
| 充入一定量H2
| H2的转化率不变,N2的转化率变大
|
D
| 使用适当催化剂
| NH3的体积分数增大
|
?
参考答案:B
本题解析:A、正方应是体积减小的,则增大压强平衡依据勒夏特列原理可知向正反应方向移动,但氮气的浓度仍然比原平衡大,A不正确;B、正方应是放热反应,则升高温度平衡显逆反应方向移动,氮气的转化率降低,B正确;C、充入一定量的氢气,平衡向正反应方向移动,氮气的转化率增大,而氢气的转化率降低,C不正确;D、催化剂只能改变反应速率而不能改变平衡状态,D不正确,答案选B。
本题难度:一般
4、选择题 把在空气中久置的铝片 5.0 g投入盛有500mL0.5mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如右的坐标曲线来表示,下列推论错误的是
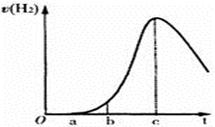
A.t由0→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液
B.t由b→c段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时反应处平衡状态
D.t>c产生氢气的速率降低主要是因为溶液中c(H+)降低
参考答案:C
本题解析:金属铝与稀硫酸的反应不是可逆反应,不存在平衡状态,选项C不正确,其余选项都是正确的,答案选C。
本题难度:简单
5、选择题 反应I2+I- I3-达到平衡时c(I3-)与温度的关系如图所示。
I3-达到平衡时c(I3-)与温度的关系如图所示。
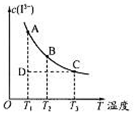
下列说法正确的是
A.图中反应进行到状态D时,一定有v逆>v正
B.A点和B点的化学平衡常数相同
C.对B点溶液升高温度时,该反应△v正>△v逆
D.增大KI溶液浓度有利于I2的溶解
参考答案:D
本题解析:A、B、C三点都是处于平衡曲线上,处于平衡状态。A .图中反应进行到状态D时,这时对应的温度是T1,A点才是平衡状态。D是不平衡状态。从D→A慢慢建立平衡过程中,c(I3-)增大,说明反应要向又进行,所以一定有v正>v逆。A错误。B.A点和B点的化学平衡常数不相同,因为T1、 T2两个不同温度。C.从A→C过程中,温度逐渐升高,c(I3-)逐渐减小,平衡向左移动,说明逆反应吸热,正反应放热。所以对B点溶液升高温度时,平衡向逆反应方向移动,该反应△v逆>△v正。D.增大KI溶液浓度,平衡像正反应方向移动,显然有利于I2的溶解
本题难度:一般