微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 锂离子电池已经成为应用最广泛的可充电电池。某种锂离子电池的结构示意图如下图所示,其中两极区间的隔膜只允许Li+通过。电池充电时的总反应方程式为:LiCoO2==Li1-xCoO2+xLi。关于该电池的推论错误的是( )

A.放电时,Li+主要从负极区通过隔膜移向正极区
B.放电时,负极反应为xLi-xe-===xLi+
C.电解质溶液不能是水溶液
D.充电时,负极(C)上锂元素被氧化
参考答案:D
本题解析:因为电池充电是LiCoO2==Li1-xCoO2+xLi,故放电是Li1-xCoO2+xLi="=" LiCoO2,Li是电池负极,放电时Li-e-===Li+,生成的Li+向正极区移动,AB正确;因为Li属于第IA金属,较活泼,与水反应,Li电极不能在水溶液中浸泡,C正确;充电时,负极Li+被还原为Li单质, D错误。
本题难度:一般
2、选择题 银锌电池广泛用作各种电子仪器的电源,它的放电过程可以表示为:Ag2O+ Zn+H2O = 2Ag+Zn(OH)2。
电池放电时,负极发生反应的物质是
[? ]
A.Ag
B.Zn
C.Ag2O
D.Zn(OH)2
参考答案:B
本题解析:
本题难度:简单
3、填空题 (本小题14分)现有A、B、C、D四种短周期主族元素,其原子序数依次增大。已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。请回答下列问题:
(1)元素D在周期表中的位置是________________________。
(2)C2B2所含的化学键类型有___________;请写出C2B2与A2B反应的离子方程式________________。
(3)元素B、C形成的简单离子中半径较大的是_________(写电子式)。
(4)仅由C、D两种元素组成的一种盐溶于水后pH>7的原因是_____________ (用离子方程式表示)。
(5)如图所示以铂作电极,以C、D两元素的最高价氧化物的水化物X、Y的溶液作为电解质溶液,A、B元素的单质分别在两电极上发生原电池反应,则通入B单质的电极反应式为_________,通入A单质的X溶液的pH将__________(填“增大”、“不变”或“减小”)。
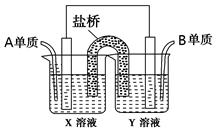
参考答案:(本小题14分,每空2分)(1)第三周期ⅥA族
(2)离子键、共价键(或非极性共价键) ; 2Na2O2+2H2O===4Na++4OH-+O2↑;
(3) (4) S2-+H2O
(4) S2-+H2O HS-+OH-;(5) O2+4H++4e-===2H2O ;减小。
HS-+OH-;(5) O2+4H++4e-===2H2O ;减小。
本题解析:根据题意可知:A是H;B是O;C是Na;D是S。(1)元素D在周期表中的位置是第三周期ⅥA族;(2)C2B2是Na2O2;属于离子化合物,在所含的化学键类型有离子键、非极性共价键;C2B2与A2B反应的离子方程式是2Na2O2+2H2O===4Na++4OH-+O2↑;(3)元素B、C形成的简单离子电子层结构相同,离子的核电荷数越大,离子半径就越小。所以离子半径较大的是O2-,其电子式是 ;(4)仅由C、D两种元素组成的一种盐Na2S是强碱弱酸盐,弱酸根离子S2-水解消耗水电离产生的H+,破坏了水的电离平衡,使水继续电离,最终当溶液达到电离平衡时,c(H+)<c(OH-),所以溶液显碱性, pH>7,用离子方程式表示是S2-+H2O
;(4)仅由C、D两种元素组成的一种盐Na2S是强碱弱酸盐,弱酸根离子S2-水解消耗水电离产生的H+,破坏了水的电离平衡,使水继续电离,最终当溶液达到电离平衡时,c(H+)<c(OH-),所以溶液显碱性, pH>7,用离子方程式表示是S2-+H2O HS-+OH-;(5)以C、D两元素的最高价氧化物的水化物X—NaOH、Y—H2SO4的溶液作为电解质溶液,A、B元素的单质H2、O2分别在两电极上发生原电池反应,则通入B单质的电极反应式为O2+4H++4e-===2H2O;通入A单质的电极反应式为H2-2e-+2OH-=2H2O,由于c(OH-)不断减小,所以溶液的pH会增大。
HS-+OH-;(5)以C、D两元素的最高价氧化物的水化物X—NaOH、Y—H2SO4的溶液作为电解质溶液,A、B元素的单质H2、O2分别在两电极上发生原电池反应,则通入B单质的电极反应式为O2+4H++4e-===2H2O;通入A单质的电极反应式为H2-2e-+2OH-=2H2O,由于c(OH-)不断减小,所以溶液的pH会增大。
考点:考查元素及化合物的推断、物质的电子式、离子方程式和原电池的电极反应式的书写的知识。
本题难度:困难
4、选择题 下列关于原电池的叙述中正确的是
A.正极和负极必须是两种不同的金属
B.原电池是把化学能转化成电能的装置
C.原电池工作时,负极上发生是还原反应
D.锌、铜和盐酸构成的原电池工作时,电子从铜片经导线流向锌片
参考答案:B
本题解析:
本题难度:一般
5、选择题 (2014届上海市六校高三第二次联考化学试卷)
铁棒和石墨棒用导线连接后,浸入0.01mol/L的氯化钠溶液中,可能出现的现象是
A.铁棒附近产生OH-
B.铁棒质量减少
C.石墨棒上放出氢气
D.石墨棒上放出氧气
参考答案:B
本题解析:
铁棒和石墨棒用导线连接后,浸入0.01mol/L的氯化钠溶液形成了原电池,由于活动性Fe>C。所以Fe作负极,发生的电极反应为Fe-2e-=Fe2+。C作正极。因为是中性溶液,所以在正极上发生反应:O2+4e-+2H2O=4OH-。在溶液中2Fe +O2+2H2O=2Fe(OH)2.
4Fe(OH)2+O2+2H2O=4Fe(OH)3.所以Fe会减少。在C棒附近产生OH-。正确选项为B。
本题难度:一般