微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定条件下,对于密闭容器中进行的可逆反应: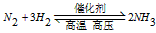 下列说法中,能充分说明这一反应已经达到化学平衡状态的是
下列说法中,能充分说明这一反应已经达到化学平衡状态的是
[? ]
A.N2、H2与NH3的物质的量之比为1︰3︰2
B.N2、H2与NH3的浓度相等
C.各组分的浓度不再发生变化
D.反应停止,正、逆反应速率都等于零
参考答案:C
本题解析:
本题难度:一般
2、填空题 (8分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母)
A.所需的活化能很高? B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)  2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:
温度/℃
| 1538
| 1760
| 2404
|
平衡常数K
| 0.86×10-4
| 2.6×10-4
| 64×10-4
|
该反应的△H?0。(填“>”、“=”或“<”)
(3)一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率, 可以采取的措施是?。
A.降低温度?B.加催化剂?
C.增加压强?D.增加O2浓度
E.分离出一氧化氮
(4)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应:
N2(g)+O2(g)  2NO(g)达到平衡时NO的浓度?。(此温度下不考虑O2与NO的反应,计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度?。(此温度下不考虑O2与NO的反应,计算结果保留两位有效数字)
(5) NO在科学界被誉为“明星分子”, 用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂。已知 火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气)。
且:N2(g)+2O2(g)=2NO2(g) ? △H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol
请写出肼与NO2反应的热化学方程式_______________________________________________
参考答案:(1)A(1分)(2) >?(1分)(3)D E(2分)(4)0.23 mol/L(2分)
(5)2N2H4(g) +2NO2(g)= 3N2(g)+4H2O(g) △H=-1135.7kJ/mol (2分
本题解析:(1)在闪电或极高温条件下发生,说明所需的活化能很高
(2)由平衡常数K可知:温度升高,K增大,说明反应向正反应方向移动,正反应吸热,即△H >0?(3)增加O2浓度,分离出一氧化氮,可以促使反应正向移动。提高N2的转化率
(4)2404℃时,K为64×10-4,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,可得
K=[NO]2/([O2]·[N2]),64×10-4 = [NO]2/(2.6·2.6),故NO的浓度为0.23 mol/L。
(5):N2(g)+2O2(g)=2NO2(g) ①? N2H4(g)+O2(g)=N2(g)+2H2O(g) ②,?②×2-①得到:
2N2H4(g) +2NO2(g)= 3N2(g)+4H2O(g)△H=-1135.7kJ/mol
点评:本题属于化学平衡和化学能与热能的常规题型,注重对基础知识的考查和应用。注意加催化剂不能提高反应物的转化率。
本题难度:一般
3、填空题 能源的相互转化和利用是科学家研究的重要课题.
(1)将水蒸气通过红热的炭即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1,
①该反应能否自发进行的外界条件是______;
②在一个恒容的密闭容器中,一定温度下发生上述反应,下列能判断该反应达到化学平衡状态的是______(填相应的编号).
A.c(CO)=c(H2) B.1molH-H键断裂的同时断裂2mol H-O键
C.容器中的压强不变 D.消耗H2O的速率等于生成H2的速率
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,在催化剂存在下进行反应:CO(g)+H2O(g)?H2(g)+CO2(g),得到如下二组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol
CO
H2O
H2
CO
1
650
4
2
1.6
2.4
2
900
2
1
0.4
1.6
|
①该反应的△H______0(填“>”“<”“=”)
②计算实验2条件下平衡常数的值K=______
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,下列措施中能使c(CH3OH)增大的是______.
A.使用合适的催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来D.再充入1molCO2和3molH2
(4)利用甲醇设计一个燃料电池:用氢氧化钾溶液作电解质溶液,用多孔石墨做电极,则放入甲醇的电极上发生的电极反应式是______.
参考答案:(1)①由热化学反应方程式可知,反应为焓增,熵增过程,即△H>0、△S>0,△G=△H-T△S<0时反应能自发进行,较高温度下才能保证△G=△H-T△S<0;
故答案为:较高温度;
②A.无论反应是否达到平衡状态,都存在c(CO)=c(H2),故A错误;
B.1molH-H键断裂的同时断裂2molH-O键,说明正逆反应速率相等,反应达到平衡状态,故B正确;
C.反应在一个容积不变的密闭容器中进行,容器中的压强由气体的物质的量决定,当压强不变时,气体的物质的量就不变,气体的物质的量浓度也不变,说明达到平衡,故C正确;
D.消耗H2O的速率和生成H2的速率都指正反应速率,故D错误;
故答案为:BC;
(2)①实验1中CO的转化率为4mol-2.4mol4mol×100%=40%实验2中CO的转化率为2mol-1.6mol2mol×100%=20%则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热;
故答案为:<;
②平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):2 10 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故900℃时该反应平衡常数k=0.4×0.41.6×0.6=0.17,
故答案为:0.17;
(3)A.加催化剂平衡不移动,c(CH3OH)不变;
B.充入He(g),平衡不移动,c(CH3OH)不变;
C.将H2O(g)从体系中分离出来,平衡正向移动,c(CH3OH)增大;
D.再充入1molCO2和3molH2,假设容器扩大一倍,达到平衡再压缩,c(CH3OH)增大;
故答案为:BC;
(4)通甲醇的电极为负极,所以甲醇失电子,甲醇燃烧生成CO2,CO2在氢氧化钾溶液中以KCO3形式存在,电极方程式为CH3OH-6e-+8OH-═CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-═CO32-+6H2O.
本题解析:
本题难度:一般
4、填空题 溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B )="0.200" mol/L及c(C )="0" mol/L。反应物A的浓度随时间的变化如图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B )="0.200" mol/L及c(C )="0" mol/L。反应物A的浓度随时间的变化如图所示。
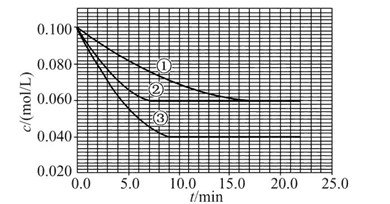
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:②?;③?。
(2)实验②平衡时B的转化率为?;实验③平衡时C的浓度为?。
(3)该反应的ΔH?0,其判断理由是?。
(4)该反应进行到4.0 min时的平均反应速率:实验②:v(B)=?。
参考答案:(1)加催化剂;达到平衡的时间缩短,平衡时A的浓度未变?温度升高;达到平衡的时间缩短,平衡时A的浓度减小
(2)40%(或0.4) 0.06 mol/L
(3)>?升高温度平衡向正反应方向移动,故该反应是吸热反应
(4)0.014 mol/(L·min)
本题解析:这是一道数形结合的反应原理试题,关键是找出图形中①②③三条曲线的转折点:达到平衡的时间①>③>②,但A的平衡浓度关系是①=②>③,说明②是使用了催化剂,③是升高温度。
(1)②使用了(正)催化剂;理由:因为从图像可看出,两者最终的平衡浓度相同,即最终的平衡状态相同,而②比①所需要的时间短,显然反应速率加快了,故由影响反应速率和影响平衡的因素可知是加入(正)催化剂;③升高温度;理由:因为该反应是在溶液中进行的反应,所以不可能是改变压强引起速率的改变,又由于各物质起始浓度相同,故不可能是改变浓度影响反应速率,再由于③和①相比,③达平衡所需时间短,平衡时浓度更小,故不可能是加催化剂,而只能是升高温度来影响反应速率的。
(2)不妨令溶液为1 L,则②中达平衡时A转化了0.04 mol,由反应计量数可知B转化了0.08 mol,所以B的转化率为 ×100%=40%;同样③中A转化了
×100%=40%;同样③中A转化了
0.06 mol,则生成C为0.06 mol,体积不变,即平衡时c(C)="0.06" mol/L。
(3)ΔH>0;理由:由③和①进行对比可知升高温度后A的平衡浓度减小,即A的转化率升高,平衡向正反应方向移动,而升温是向吸热的方向移动,所以正反应是吸热反应,ΔH>0。
(4)从图上读数,进行到4.0 min时,实验②A的浓度为:0.072 mol/L,则Δc(A)=0.100-0.072=0.028(mol/L),v(A)=Δc(A)/Δt=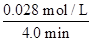 ?=
?=
0.007 mol/(L·min),所以 v(B)="2v(A)=0.014" mol/(L·min)。
本题难度:一般
5、选择题 在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应:A(s)+2B(g)?C(g)+D(g)已达平衡状态的是( )
A.混合气体的压强
B.混合气体的密度
C.A的密度
D.气体总物质的量
参考答案:A、可逆反应:A(s)+2B(g)?C(g)+D(g),反应前后,气体的物质的量不发生变化,体积恒定,反应自开始到平衡,压强都是一定值,故A错误;
B、A是固体,根据质量守恒,随着反应进行,气体的质量在增加,当气体的总质量不发生变化时,说明到达平衡状态,故B正确;
C、无论该反应是否达到平衡状态,A的密度始终不变,故C错误;
④该反应是一个反应前后气体体积不变的化学反应,无论该反应是否达到平衡状态,气体的总物质的量始终不变,故D错误.
故选B.
本题解析:
本题难度:一般