微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经此反应的逆反应,生成颗粒很细的铁粉。某校化学小组利用下图所列装置进行铁与水反应的实验,并利用产物进一步与四氧化三铁反应制取铁粉。(装置中的铁架台、铁夹等必要的夹持仪器在图中均已略去)
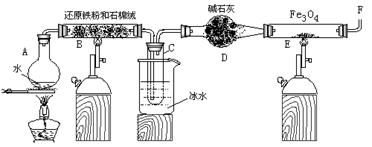
(1)烧瓶A中常加入碎瓷片,其作用是 ,B中石棉绒的作用 ,小试管C的作用是 。
(2)反应开始时先点燃 处(填A或B)酒精灯,为了安全,在E管中的反应发生前,在F出口处必须 ,E管中的反应开始后,在F出口处应 。
(3)写出高温下Fe 与H2O(g)反应的化学方程式 ,在一定条件下该反应实际上是可逆反应,试用化学平衡移动原理加以解释本实验中是如何实现Fe向Fe3O4的转变的 。
(4)停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中含有Fe3+的实验操作及现象____________________________________________________。
参考答案:26. (1) 防止液体暴沸;增大铁粉与水蒸气的接触面积;冷凝水蒸气。
(2)A;检验氢气的纯度;点燃氢气。(3) (2分);
(2分);
实验中不断通入水蒸气增大反应物浓度,并移走氢气减小生成物浓度,从而使反应正向进行。
(4)取滤液少量,向其中滴加KSCN溶液,若溶液变为血红色,即证明含有Fe3+。
本题解析:(1)烧瓶的作用就是加热液体或者对液体进行蒸馏,为了防止液体暴沸,常加入碎瓷片;B中发生反应 ,为了增大铁粉与水蒸气的接触面积,常放入石棉绒;因为利用产物H2进一步与四氧化三铁反应制取铁粉,所以需要将未反应的水蒸气除去,所以小试管C的作用是冷凝水蒸气;(2)因为氢气不能排放到空气中,氢气在空气中燃烧容易发生爆炸,所以反应开始时先点燃A处的酒精灯,为了安全,在E管中的反应发生前,在F出口处必须检验氢气的纯度,E管中的反应开始后,在F出口处应点燃氢气。(3)高温下Fe 与H2O(g)反应的化学方程式为
,为了增大铁粉与水蒸气的接触面积,常放入石棉绒;因为利用产物H2进一步与四氧化三铁反应制取铁粉,所以需要将未反应的水蒸气除去,所以小试管C的作用是冷凝水蒸气;(2)因为氢气不能排放到空气中,氢气在空气中燃烧容易发生爆炸,所以反应开始时先点燃A处的酒精灯,为了安全,在E管中的反应发生前,在F出口处必须检验氢气的纯度,E管中的反应开始后,在F出口处应点燃氢气。(3)高温下Fe 与H2O(g)反应的化学方程式为 ,为了使上述反应向右移动,根据平衡移动原理,可以不断通入水蒸气增大反应物浓度,并移走氢气减小生成物浓度,从而使反应正向进行;(4)根据Fe3+的检验方法,最佳试剂用KSCN溶液,所以证明滤液中含有Fe3+的实验操作及现象是取滤液少量,向其中滴加KSCN溶液,若溶液变为血红色,即证明含有Fe3+。
,为了使上述反应向右移动,根据平衡移动原理,可以不断通入水蒸气增大反应物浓度,并移走氢气减小生成物浓度,从而使反应正向进行;(4)根据Fe3+的检验方法,最佳试剂用KSCN溶液,所以证明滤液中含有Fe3+的实验操作及现象是取滤液少量,向其中滴加KSCN溶液,若溶液变为血红色,即证明含有Fe3+。
考点:考查铁粉与水蒸气的反应,实验基本操作,影响平衡移动的因素,离子的检验。
本题难度:一般
2、填空题 (14分)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上常用CO和H2反应生产CH3OH,并开发出甲醇燃料电池。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0 kJ·mol-1
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)工业上常利用反应CO(g)+2H2(g) CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。
CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。
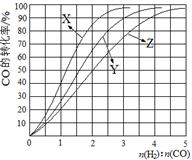
230℃的实验结果所对应的曲线是 (填字母);该温度下工业生产适宜采用的合成气组成n(H2):n(CO) 的比值范围是 (填字母) 。
A.1~1.5 B.2.5~3 C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:H2O(g)+CO(g) H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
①该温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
②若降低温度,该反应的K值将 (填“增大”、“减小”或“不变”)。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。

①该电池工作时,OH-向 极移动(填“a”或“b”)。
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为 。
参考答案:(每空2分,共14分)(1)CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=—443.5 kJ
本题解析:
本题难度:困难
3、填空题 (8分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
回答下列问题:
(1)该反应的化学平衡常数表达式为K= ;
(2)该反应为 反应(选填吸热、放热);
(3)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为 ℃;
(4)830℃时,向该容器中加入1L CO2与1L H2 ,平衡时CO2的体积分数是 。
参考答案:(1)K=_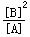 _。
_。
(2) _放热_(填“吸热”或“放热”)反应。
(3)减小__(填“增大”、“减小”或“不变”,下同),_增大____。
(4)不移动(填“向左”、“向右”、“不移动”),增大A的浓度 _,__B
本题解析:略
本题难度:困难
4、选择题 8.在2NO2(红棕色)  N2O4(无色)的可逆反应中,下列状态一定达到化学平衡状态的是
N2O4(无色)的可逆反应中,下列状态一定达到化学平衡状态的是
A.N2O4和NO2的分子数比为1