微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式正确的是
[? ]
A.用氯气作为水的消毒剂:Cl2+H2O===2H++Cl-+ClO-
B.“胃舒平”里的氢氧化铝中和胃酸:Al(OH)3+3H+===Al3++3H2O
C.金属钠溶于足量水中:Na+2H2O=Na++H2↑+2OH-
D.过量铁屑溶于少量稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
参考答案:B
本题解析:
本题难度:一般
2、填空题 (1)实验室中常用加热分解氯酸钾制取氧气,写出反应的化学方程式,并用双线桥法标出电子转移情况:?。
(2)生活中常用食醋除去水壶中的水垢(主要成分是碳酸钙固体)的离子方程为:?。
(3)钢铁在潮湿环境中溶液锈蚀,反应的氧化剂是?。工业上常用稀硫酸进行焊接前除锈(主要成分是Fe2O3?xH2O),反应的离子方程为:?。
(4)医疗上常用小苏打治疗胃酸过多,小苏打溶液与盐酸反应的离子方程式为:?。
参考答案:(1)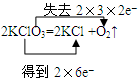 ?
?
(2) CaCO3 +2CH3COOH= Ca2++2CH3COO-+H2O+CO2↑。
(3)O2(氧气),(1分)Fe2O3 +6H+=2 Fe3++3H2O或Fe2O3?xH2O +6H+=2 Fe3++(3+x)H2O。
(4) HCO3- + H+= H2O+CO2↑。
本题解析:本题主要考查的是氧化还原反应中电子转移的方向和数目的表示方法:双线桥法。以及离子方程式的书写。
本题难度:一般
3、填空题 阅读下面的图示,回答问题:
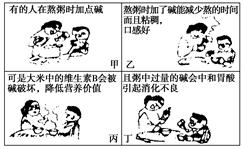
(1)图中所说的“碱”指的是________(俗名)。
(2)用离子方程式表示图丁中的化学反应原理?。
(3)患胃溃疡的病人不能服用含小苏打的药片来中和胃酸,其原因是_______________________________________________________而是服用胃舒平[其中含Al(OH)3],相应的离子方程式_________________________。
参考答案:(1)纯碱或者苏打(1分)
(2)2H++CO32-===H2O+CO2↑
(3)因NaHCO3与盐酸反应会生成CO2,可能会造成胃壁穿孔
Al(OH)3+3H+===Al3++3H2O
本题解析:纯碱溶液呈碱性,但纯碱却不属于碱类,而属于盐类物质,中和胃酸时,会生成大量CO2,可能会造成患胃溃疡病人胃穿孔,应改用胃舒平[主要成分为Al(OH)3]。
点评:本题考查钠盐的俗名及其在生活中的应用,通过书写离子方程式理解反应原理,题目难度不大。
本题难度:一般
4、选择题 下列反应的离子方程式正确的是(? )
A.足量的溴化亚铁和少量的氯气反应:2Fe2++Cl2=2Fe3++2Cl-
B.亚硫酸氢铵和氢氧化钠的反应: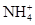 +OH-
+OH- NH3↑+H2O
NH3↑+H2O
C.二氧化硫气体通入过量的Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D.Ca(HCO3)2溶液与少量NaOH溶液反应: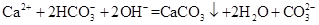
参考答案:A
本题解析:还原性Fe2+>Br-,氯气不足时,氯气先氧化Fe2+,A正确;亚硫酸氢铵和氢氧化钠反应时,优先进行反应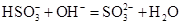 ,NaOH过量时再发生反应:NH4++OH-
,NaOH过量时再发生反应:NH4++OH- NH3↑+H2O,B错;HClO具有强氧化性,能氧化CaSO3,C错;NaOH溶液少量时的离子方程式是:Ca2++
NH3↑+H2O,B错;HClO具有强氧化性,能氧化CaSO3,C错;NaOH溶液少量时的离子方程式是:Ca2++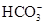 ?+OH-=CaCO3↓+H2O,D错
?+OH-=CaCO3↓+H2O,D错
本题难度:一般
5、简答题 写出CuSO4溶液和BaCl2溶液反应的离子方程式______,发生了该反应的实验现象是______.为了检验某些离子实际上没有参加反应,还要进行的实验是(简要地写出实验操作过程)______.
参考答案:CuSO4溶液和BaCl2溶液发生复分解反应生成BaSO4白色沉淀,反应的离子方程式为Ba2++SO42-=BaSO4↓,
反应后溶液中含有Cu2+和Cl-离子,静置后,观察上层清液为蓝色,说明Cu2+未参加反应,然后取上层清液,滴入用硝酸酸化的硝酸银溶液,产生白色沉淀,说明Cl-未参加反应.
故答案为:Ba2++SO42-=BaSO4↓;产生白色沉淀;静置后,观察上层清液为蓝色,说明Cu2+未参加反应,取上层清液,滴入用硝酸酸化的硝酸银溶液,产生白色沉淀,说明Cl-未参加反应.
本题解析:
本题难度:一般