微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 物质的量浓度各为0.1mol?L-1的CH3COOH和CH3COONa溶液等体积混合后,溶液呈酸性.下列关系式正确的是( )
A.[Na+]+[H+]=[CH3COO-]+[OH-]=0.05mol?L-1
B.[CH3COO-]+[CH3COOH]=0.2mol?L-1
C.[CH3COO-]>[Na+]>[H+]>[OH-]
D.[Na+]>[CH3COO-]>[H+]>[OH-]
参考答案:A、物质的量浓度各为0.1mol?L-1的CH3COOH和CH3COONa溶液等体积混合后,溶液中c(Na+)=0.05mol/L,
则c(Na+)+c(H+)>0.05mol/L,故A错误;
B、物质的量浓度各为0.1mol?L-1的CH3COOH和CH3COONa溶液等体积混合后,溶液为原来的体积的2倍,
则有:c(CH3COOH)+c(CH3COO-)=0.1mol/L,故B错误;
C、等体积混合后,溶液呈酸性,则说明CH3COOH电离程度大于CH3COO-水解程度,所以c(CH3COO-)>c(Na+),故C正确;
D、溶液c(CH3COO-)>c(Na+),故D错误.
故选C.
本题解析:
本题难度:简单
2、选择题 下列有关电解质的电离和水解说法正确的是(?)
A.在25℃时,任何水溶液中Kw=1×10-14。
B.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-)
C.在pH=2的盐酸酸化的FeCl3溶液,稀释至10倍,则溶液pH=3
D.0.1mol/L醋酸溶液中加入冰醋酸,平衡正向移动,醋酸的电离程度增大
参考答案:B
本题解析:A.在25℃时,在任何物质的稀的水溶液中存在着Kw=1×10-14。如果浓度较大,就不符合。错误。B.在溶液中H+由H2O和NaHSO4共同电离产生。NaHSO4=Na++H++ SO42-.;H2O H++OH-.故c(H+)=c(OH-)+c(SO42-)。正确。C.在pH=2的盐酸酸化的FeCl3溶液,若稀释至10倍,若盐水解的程度不变则溶液pH=3,但稀释使FeCl3的水解程度增大故溶液2<pH<3.错误。D.0.1mol/L醋酸溶液中加入冰醋酸,平衡正向移动,但是增加的醋酸比平衡移动减少的醋酸要多,该醋酸的电离程度反而减小。错误。
H++OH-.故c(H+)=c(OH-)+c(SO42-)。正确。C.在pH=2的盐酸酸化的FeCl3溶液,若稀释至10倍,若盐水解的程度不变则溶液pH=3,但稀释使FeCl3的水解程度增大故溶液2<pH<3.错误。D.0.1mol/L醋酸溶液中加入冰醋酸,平衡正向移动,但是增加的醋酸比平衡移动减少的醋酸要多,该醋酸的电离程度反而减小。错误。
本题难度:一般
3、选择题 氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是
[? ]
A.再通入少量氯气,c(H+)/c(ClO-)减小
B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量固体NaOH,溶液的pH会略微增大
参考答案:D
本题解析:
本题难度:一般
4、简答题 某化学兴趣小组的同学通过实验比较等体积(200mL)0.55mol/L硫酸、1.1mol/L盐酸、1.1mol/L醋酸分别与过量金属反应生成氢气的速率请你协助完成如下实验,并回答相关问题.
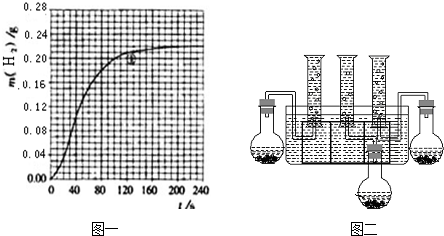
(1)实验用品:仪器(略)、药品(除给定的三种酸溶液外,在Na、Mg、Fe三种金属中选择最合适的一种,并说明理由).选择的金属是______,不选其它两种金属的理由是______.
(2)实验原理:(用离子方程式表示)______.
(3)甲同学设计的实验装置,乙同学认为该装置不能控制三个反应在同一时间发生,并作了相应的改进.你认为乙同学改进的措施是:______.
(4)按改进后的装置进行实验,实验中HCl与金属反应产生H2质量随时间变化的关系见图一,计算实验在80-120s范围内HCl的平均反应速率______(忽略溶液体积变化,写出计算过程).
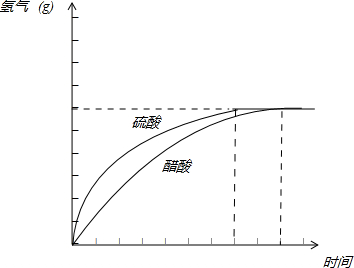
(5)请在答题卡的框图中,画出HAc、H2SO4与金属反应产生H2质量随时间变化关系的预期结果示意图.
(6)量筒的规格由______决定.
(7)对盐酸和醋酸反应图象的异同,你的解释是______.
参考答案:(1)Na太活泼,能和水反应产生氢气,影响实验结论;Fe与酸反应的速率较慢,实验时间较长.故镁较合适,
故答案为:Mg;由于Na太活泼,能和水反应产生氢气,影响实验结论;Fe与酸反应的速率较慢,实验时间较长;
(2)镁与硫酸、盐酸反应实质为,镁与氢离子反应,置换出氢气,反应离子方程式为2H++Mg=H2↑+Mg2+,
醋酸是弱电解质,应写化学式,离子方程式为?2CH3COOH+Mg=H2↑+Mg2++2CH3COO-,
故答案为:2H++Mg=H2↑+Mg2+、2CH3COOH+Mg=H2↑+Mg2++2CH3COO-;
(3)保证同时向三烧瓶内加入酸,可同时用分液漏斗分别向烧瓶中加入酸液,故答案为:同时用分液漏斗分别向烧瓶中加入酸液;
(4)由图可知,80-120s范围内生成氢气的质量为0.21g-0.18g=0.03g,
?2HCl~H2 ↑?
2mol? 2g
nmol? 0.03g
所以n=0.03mol
所以△c(HCl?)=0.03mol0.2L=0.15mol/L,
所以v(HCl?)=0.15mol/L40s=0.00375mol/(L.min),
故答案为:0.00375mol/(L.min);
(5)硫酸中氢离子浓度大于醋酸中氢离子浓度,反应速率硫酸比醋酸快,两种提供的氢离子的物质的量相等,最后生成的氢气一样多.HAc、H2SO4与金属反应产生H2质量随时间变化关系的示意图为:
,故答案为:

;
(6)量筒用于测量生成氢气的体积,氢气的体积取决于酸溶液的体积,故答案为:酸溶液的体积;
(7)醋酸中存在电离平衡,反应开始时c(H+)小于盐酸,故反应速率也小于盐酸.由于醋酸、盐酸最终提供的H+的物质的量相等,故最后的得到H2体积相等,
故答案为:醋酸中存在电离平衡,反应开始时c(H+)小于盐酸,故反应速率也小于盐酸.由于醋酸、盐酸最终提供的H+的物质的量相等,故最后的得到H2体积相等.
本题解析:
本题难度:一般
5、选择题 对某弱酸稀溶液加热时,下列叙述错误的是(?)
A.弱酸的电离程度增大
B.弱酸分子的浓度减小
C.溶液的c(OH-)增大
D.溶液的导电性增强
参考答案:C
本题解析:电离一般为吸热反应,升高温度,平衡向正反应方向移动。
本题难度:简单