微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知难溶性的硫酸铅与醋酸铵溶液反应得到无色澄清溶液,反应的离子方程式是PbSO4+2CH3COO-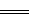 (CH3COO)2Pb+
(CH3COO)2Pb+ ,据此判断醋酸铅是
,据此判断醋酸铅是
A.易溶强电解质
B.易溶弱电解质
C.难溶强电解质
D.难溶弱电解质
参考答案:B
本题解析:
PbSO4+2CH3COONH4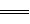 (CH3COO)2Pb+(NH4)2SO4属于复分解反应,使其反应至少需要满足下列三个条件中的一个:有难溶性物质(如沉淀)、挥发性物质(如气体)、难电离物质(如水)。(NH4) 2SO4是可溶性盐,(CH3COO)2Pb是无色澄清溶液,所以(CH3COO)2Pb必定是难电离物质,即弱电解质,在书写离子方程式时应保留化学式的形式。选B。
(CH3COO)2Pb+(NH4)2SO4属于复分解反应,使其反应至少需要满足下列三个条件中的一个:有难溶性物质(如沉淀)、挥发性物质(如气体)、难电离物质(如水)。(NH4) 2SO4是可溶性盐,(CH3COO)2Pb是无色澄清溶液,所以(CH3COO)2Pb必定是难电离物质,即弱电解质,在书写离子方程式时应保留化学式的形式。选B。
本题难度:一般
2、选择题 25℃时,有关弱酸的电离平衡常数如下:下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3
电离平衡常数(25℃)
1.8×10-5
4.9×10-10
K1=4.3×10-7K2=5.6×10-11
|
A.等物质的量浓度的各溶液pH关系为:CH3COONa>Na2CO3>NaCN
B.a?mol/L?NaOH溶液与b?mol/LHCN溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.在冰醋酸中逐滴加水,则溶液的导电性和醋酸的电离程度均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
参考答案:A、根据电离平衡常数可知酸性强弱顺序为:CH3COOH>HCN>HCO3-,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大,物质的量浓度的各溶液pH关系为:
pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故A错误;
B、如c(Na+)>c(CN-),根据溶液电中性可知c(H+)<c(OH-),溶液呈碱性,a<b或a═b都符合,故B错误;
C、冰醋酸属于弱电解质,加水促进电离,冰醋酸中逐滴加水,溶液的导电性先增大后减小,pH先减小后增大,醋酸的电离程度逐渐增大,故C错误;
D、Na2CO3和NaHCO3等物质的量混合溶液中,存在的阳离子有Na+、H+,阴离子有OH-、HCO3-、CO32-,根据溶液电中性,存在C(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D正确;
故选D.
本题解析:
本题难度:简单
3、简答题 硼是第ⅢA族的元素,自然界中有许多硼化合物,如:
| 硼镁矿 | 硼砂 | 硼酸 | 偏硼酸钠
Mg2B2O5?H2O
Na2B4O7?10H2O
H3BO3
NaBO2
|
请回答下列问题:
(1)上述所列硼化合物中,硼的质量分数最高的是:______;
(2)工业上以硼镁矿为原料制取硼.该工艺的中间过程会发生反应:B2O3+3Mg=2B+3MgO,反应的氧化剂是:______;
(3)上述所得的粗硼与MgO混在一起,难以分离,工业上往往将粗硼与I2作用形成BI3(沸点210℃)然后与MgO分离,分离的方法是______;最后在1000℃左右,通过BI3热分解而得到高纯度B.
(4)硼酸是一种一元弱酸,它与水作用时结合水电离的OH-而释放出水电离的H+,写出这一变化的化学方程式______.皮肤上不小心碰到氢氧化钠溶液,一般先用大量水冲洗,然后再涂上硼酸溶液,写出硼酸与氢氧化钠反应的离子方程式______.
参考答案:(1)由表中含B物质NaBO2中B的含量为1123+11+32,H3BO3中B的含量为113+11+48,Mg2B2O5?H2O中B的含量为11×224×2+11×2+16×5+18,Na2B4O7?10H2O中B的含量为11×423×2+11×4+16×7+18×10,所以H3BO3中B元素含量最高,故答案为:硼酸;
(2)B2O3+3Mg=2B+3MgO中B元素化合价从+3价降低到0价,作氧化剂,故答案为:B2O3;
(3)已知BI3的沸点210℃,而MgO的沸点很高,所以可以利用沸点不同分离,故答案为:加热冷凝法;
(4)由题意可知硼酸与水作用时结合水电离的OH-而释放出水电离的H+,所以H3BO3+H2O?[B(OH)4]-+H+,硼酸是一种一元弱酸,能与氢氧化钠反应,其反应方程式为 H3BO3+NaOH=Na[B(OH)4],所以离子方程式为 H3BO3+OH-=[B(OH)4]-,故答案为:H3BO3+H2O?[B(OH)4]-+H+; H3BO3+OH-=[B(OH)4]-.
本题解析:
本题难度:一般
4、选择题 在0.1 mol·L-1的HCN溶液中存在如下电离平衡HCN H++CN-,对该平衡,下列叙述正确的是( )
H++CN-,对该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡向正反应方向移动
B.加水,平衡向逆反应方向移动
C.滴加少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减少
D.加入少量NaCN固体,平衡向正反应方向移动
参考答案:A
本题解析:加NaOH固体,OH-+H+ H2O,平衡正向移动,A项正确;加水平衡正向移动,B项错误;滴加少量0.1 mol·L-1 HCl溶液,c(H+)增大,C项错误;加入少量NaCN固体,c(CN-)增大,平衡逆向移动。
H2O,平衡正向移动,A项正确;加水平衡正向移动,B项错误;滴加少量0.1 mol·L-1 HCl溶液,c(H+)增大,C项错误;加入少量NaCN固体,c(CN-)增大,平衡逆向移动。
本题难度:一般
5、选择题 把0.05mol NaOH固体分别加入到100mL下列溶液中,溶液的导电能力变化最小的是
A.自来水
B.0.05mol·L-1盐酸
C.0.05mol·L-1CH3COOH溶液
D.0.05mol·L-1KCl溶液