微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)维生素和微量元素是生命基础的重要物质。如中学生每天需要补充维生素C约60 mg,微量元素碘约150 μg。
 (1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变?色。
(1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变?色。 某同学欲探究维生素C的还原性,可选择的试剂是?(填序号)。
某同学欲探究维生素C的还原性,可选择的试剂是?(填序号)。
 ①氨水、淀粉?
①氨水、淀粉? ?② KI溶液?③酸性KMnO4溶液
?② KI溶液?③酸性KMnO4溶液
 (2)加碘盐可预防碘缺乏症,其中加入的含碘物质是碘酸钾。碘酸钾的化学式为?(填序号)。
(2)加碘盐可预防碘缺乏症,其中加入的含碘物质是碘酸钾。碘酸钾的化学式为?(填序号)。
 ① I2?
① I2? ?② KI?③ KIO3
?② KI?③ KIO3
 已知在酸性条件下,碘化钾与碘酸钾反应可生成碘单质。若用盐酸酸化的碘化钾淀粉溶液检验加碘盐中的碘酸钾,可观察到的现象是?。
已知在酸性条件下,碘化钾与碘酸钾反应可生成碘单质。若用盐酸酸化的碘化钾淀粉溶液检验加碘盐中的碘酸钾,可观察到的现象是?。
2、选择题 下列反应中,属于氮的固定的是(?)
A.空气在雷电的作用下产生NO
B.NH3经催化氧化生成NO
C.NO2和H2O反应生成HNO3
D.由NH3制碳酸铵或硫酸铵
3、选择题 下图为两个连通容器,中间用活塞分开,左、右两室各充入一定量NO和O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应,最终容器内混合气体密度与原来相比(?)
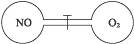
A.增大
B.减小
C.不变
D.无法确定
4、选择题 下列食品添加剂与类别对应不正确的是(?)
A.调味剂——亚硝酸钠
B.防腐剂——苯甲酸钠
C.疏松剂——碳酸氢钠
D.着色剂——叶绿素
5、填空题 (14分)氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)氨气催化氧化的化学方程式为?。
 ?(2)工业合成氨的热化学方程式为:N2(g)+3H2(g)? 2NH3(g);△H=-92.2kJ/mol。
?(2)工业合成氨的热化学方程式为:N2(g)+3H2(g)? 2NH3(g);△H=-92.2kJ/mol。
有关键能:N="N945.6kJ/mol" N-H391.0kJ/mol,则H—H键能为?。
(3)500°C、50Mpa时,在容积为VL的定容器中加入n mol N2、3n mol H2,反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值为?。
(4)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得。部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:
物质
| △H(kJ/mol)
|
H2(g)
| -285.8
|
CO(g)
| -283.0
|
CH4(g)
| -890.3
|
?已知1 mol H2O(g)转变为1molH2O(l)时放热44.0kJ。写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式?。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制取新型燃料电池。写出该电池的正极反应式?。
(6)若把标准状况下6.72L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是
?,溶液中离子浓度从大到小的顺序是?。