微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A.SO2的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1
D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同
2、选择题 X,Y,Z三种气体,把a molX和b molY充入一密闭容器中,发生反应:X+2Y 2Z达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )
2Z达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )
A.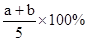
B.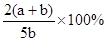
C.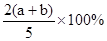
D.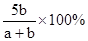
3、选择题 一定温度下,体积为2 L的密闭容器中X、Y、Z三种气体的初始物质的量和平衡物质的量如下表:
物质
| X
| Y
| Z
|
初始物质的量(mol)
| 0.2
| 0.2
| 0
|
平衡物质的量(mol)
| 0.1
| 0.05
| 0.1
|
?
下列说法正确的是(?)
A.反应可表示为2X+3Y 2Z,其平衡常数为8 000
2Z,其平衡常数为8 000
B.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.若将容器的体积压缩至1 L,则X的体积分数减小,浓度增大
D.若升高温度时,Z的浓度增大,可知温度升高时正反应速率增大,逆反应速率减小,平衡向正反应方向移动
4、选择题 一定温度下,在固定容积、体积为2L的密闭容器中充入1molN2和3molH2发生反应,当反应进行到10s末时反应达到平衡,此时容器中c(NH3) = 0.1mol/L。下列有关判断不正确的是
[? ]
A.反应达平衡时N2的转化率为10%
B.该反应达到平衡时,N2的平衡浓度为0.45 mol/L
C.该反应达到平衡时的压强是起始时压强的0.95倍
D.反应进行到10s末时,H2的平均反应速率是0.03mol/(L·s)
5、填空题 将2mol H2O和2mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H2O(g)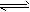 2H2+O2、2CO+O2
2H2+O2、2CO+O2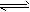 2CO2。
2CO2。
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是_____________和__________,或__________和__________。(填它们的分子式)
?(2)若平衡时O2和CO2的物质的量分别为:n平(O2)=amol,n平(CO2)=bmol。试求n平(H2O)=________
(用含a、b的代数式表示)