| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《物质的组成》高频试题强化练习(2017年最新版)(三)
⑶已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与盐酸反应的离子方程式: ?。 ⑷上述元素⑦形成的晶体对应的晶胞为下图中的___________________(填写序号)。 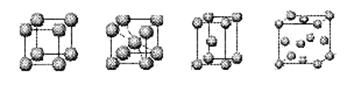 甲?乙?丙?丁 ⑸元素④的含氧酸的结构式可表示为 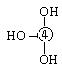 则可判断该酸为 酸(填强或弱) 则可判断该酸为 酸(填强或弱)一分子该酸与水作用,只能产生1个H+,请写出该酸溶于水后溶液显酸性的离子方程式 ?。 ⑹已知元素⑧气态氯化物的化学式为R2Cl6,结构式如下,试并标出其中的配位键 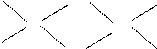 Cl? Cl? Cl Cl? Cl? ClAl? Al Cl? Cl? Cl 5、选择题 下列有关化学用语使用正确的是(?)? |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《物质的组成.. | |