|
高中化学必备知识点《物质组成与性质实验方案的设计》试题预测(2017年最新版)(四)
2017-08-10 02:36:14
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。甲同学认为两者反应只生成CuCO3一种沉淀;乙同学认为这两者相互促进水解,只生成Cu(OH)2一种沉淀;丙同学认为生成了
CuCO3和Cu(OH)2两种沉淀。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
(1)按照乙同学的理解,向生成的沉淀中加入________试剂,若观察到________时,就说明乙同学的猜想正确,则Na2CO3溶液和CuSO4溶液反应的离子方程式为:_______________________;
(2)定量探究生成物的成分将沉淀通过_______、洗涤的操作从溶液中分离出来,再低温干燥,然后定量分析沉淀物成分。
(3)若沉淀中CuCO3和Cu(OH)2两者都有,可通过下列所示装置的连接,进行定量分析来测定其质量(设每一装置中的反应或吸收均完全,反应前系统中存在的空气忽略不计)。

①上述各装置连接顺序为_____→_____→_____→_____→_____;
②实验结束时要通入过量的空气,其作用是____________________;
③若沉淀样品的质量为m克,CO2吸收装置质量增加了n克,则沉淀中Cu(OH)2的质量分数为:_____;
④能证明甲同学说法正确的实验现象是____________________。
参考答案:(1)稀盐酸;无气体产生(答案合理即可);Cu2++CO32-+H2O= Cu(OH)2↓+CO2↑
(2)过滤
(3)①C → A → B → D → E (或: C → A → B → E → D );
②排出装置中滞留的H2O和CO2气体,以便完全吸收;
③1-(31n/11m)
④装置B质量不增加(或不变)
本题解析:
本题难度:一般
2、实验题 (10分)研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义。某学习小组查阅资料并进行相关探究,请帮忙完成以下探究。
(1)pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3 mol/L,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图。请回答下列问题:(若离子浓度小于10-5mol/L,可认为该离子不存在)
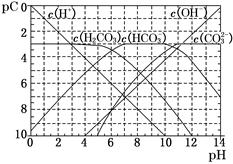
①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存。
②H2CO3一级电离平衡常数的数值Ka1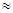 ??。 ??。
③人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)可以抵消少量酸或碱,维持pH 7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将?。 7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将?。
A.变大
B.变小
C.基本不变
D.无法判断
| (2)高温时,用CO还原MgSO4可制备高纯MgO。由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图,
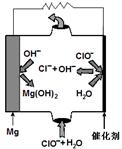
该电池反应的离子方程式为?。
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为: CO2(g) +3H2(g)  ?CH3OH(g) +H2O(g)? △H ; ?CH3OH(g) +H2O(g)? △H ;
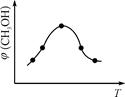
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图
所示,则上述CO2转化为甲醇反应热ΔH?0(填“>” “<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
容?器
| 甲
| 乙
| 反应物
投入量
| 1molCO2
3molH2
| a molCO2、b molH2、
c molCH3OH(g)、c molH2O(g)
|
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中各物质浓度相同,且起始时维持反应逆向进行,则c的取值范围为????。
参考答案:(共10分)
(1)①不能 ?(1分) ②10-6 (2分) ③A (1分)
(2)Mg + ClO- + H2O = Cl- + Mg(OH)2(2分)。
(3)①<? (2分)? ② 0.4<c≤1?(2分)。
本题解析:(1)①:H2CO3会发生电离出H+, HCO3-会发生电离出H+和发生水解结合H+, CO32-会发生水解与H+结合,故H2CO3、HCO3-、CO32-不能大量共存。②分析图中可以看到当PH=6时H2CO3发生一极电离,因此Ka1 10-6。③过量的酸含有大量的H+,因此c(H+)/c(H2CO3)最终将变大。 10-6。③过量的酸含有大量的H+,因此c(H+)/c(H2CO3)最终将变大。
(2)由图中分析得出,Mg是负极,失去电子,生成Mg(OH)2,ClO-会得到电子生成Cl-,因此电池反应的离子方程式为:Mg + ClO- + H2O = Cl- + Mg(OH)2。
(3)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0。
故答案为:<。
②根据分析化学方程式,反应前后的化学总物质的量之比是2:1,又因为甲中平衡后气体的压强为开始时的0.8倍,因此c的最小量为0.8/[(1mol+3mol)/2]=0.4mol,最大值为1mol,故c的取值范围为:0.4<c≤1。
点评:(1)本题考查弱电解质在水溶液中的电离及图象,学生能正确了利用图象来分析是解答本题的关键,并注意利用习题中的信息来解答,难度不大.(2)本题从多个角度对化石燃料进行了全面的考查,难度中等,培养了学生分析问题解决问题的能力.
本题难度:一般
3、实验题 镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下
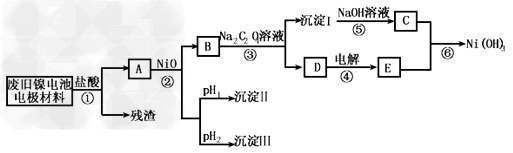
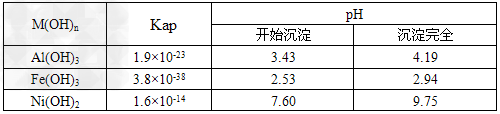
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+ ? ②某温度下一些金属氢氧化物的Kap及沉淀析出的理论pH如下表所示
回答下列问题:
(1)根据上表数据判断步骤②依次析出沉淀Ⅱ________和沉淀Ⅲ_________(填化学式),则pH1________pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用_____。
A.pH试纸 B.石蕊指示剂?C.pH计
(2)已知溶解度:NiC2O4·H2O>NiC2O4·2H2O,则③的化学方程式是______________。第③步反应后,过滤沉淀嘶需的玻璃仪器有_____________。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因______________、______________?。
(3)④中阳极反应产生的气体E为____________,验证该气体的试剂为______________。
(4)试写出⑥的离子方程式_____________________。?
参考答案:(1)Fe(OH)3;Al(OH)3;<;C
(2)NiCl2 + Na2C2O4 + 2H2O = NiC2O4·2H2O↓ + 2NaCl;漏斗、玻璃棒、烧杯;玻璃棒划破滤纸;滤液超过滤纸边缘
(3)Cl2;淀粉碘化钾溶液
(4)2Ni(OH)2 + 2OH- + Cl2 = 2Ni(OH)3+ 2Cl-
本题解析:
本题难度:一般
4、填空题 辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
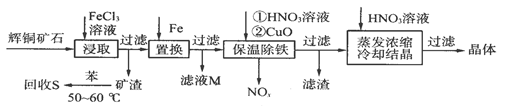
⑴写出浸取过程中Cu2S溶解的离子方程式:____________________。
⑵回收S过程中温度控制在50~60℃之间,不宜过高或过低的原因是_____________。
⑶气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为___________________________;向滤液M中加入(或通入)下列__________(填字母)物质,得到另一种可循环利用的物质。
a.铁? b.氯气? c.高锰酸钾?
⑷保温除铁过程中,加入CuO的目的是________________________;蒸发浓缩时,要用HNO3溶液调节溶液的pH,其理由是___________________________。
参考答案:(1)Cu2S+4Fe3+=2Cu2++4Fe2++S
(2)温度过高苯容易挥发,温度过低溶解速率小;
(3)4NOx+(5-2x)O2+2H2O= 4HNO3? b,(4)调节溶液的pH,使铁元素(Fe3+)完全转化为Fe(OH)3沉淀抑制Cu2+的水解(不引入其他杂质)
本题解析:(1)Fe3+ 作氧化剂,Cu2S被氧化,离子议程式为:Cu2S+4Fe3+=2Cu2++4Fe2++S,答案:Cu2S+4Fe3+=2Cu2++4Fe2++S;(2)苯沸点比较低,温度过高苯容易挥发,从反应动力学来看,温度过低溶解速率小;答案:温度过高苯容易挥发,温度过低溶解速率小;(3)NOx作还原剂,根据质量守恒和电子得失写出方程式: 4NOx+(5-2x)O2+2H2O= 4HNO3;向滤液M中通入Cl2将FeCl2氧化成FeCl3,可循环使用,选b, 答案: 4NOx+(5-2x)O2+2H2O= 4HNO3;b;(4)Fe3++3H2O Fe(OH)3+3H+ ,加入CuO,使水解平衡正向进行,调节溶液的pH,使铁元素(Fe3+)完全转化为Fe(OH)3沉淀;加热过程中Cu2+ 会水解,加入硝酸抑制Cu2+的水解(不引入其他杂质);答案:调节溶液的pH,使铁元素(Fe3+)完全转化为Fe(OH)3沉淀?抑制Cu2+的水解(不引入其他杂质) Fe(OH)3+3H+ ,加入CuO,使水解平衡正向进行,调节溶液的pH,使铁元素(Fe3+)完全转化为Fe(OH)3沉淀;加热过程中Cu2+ 会水解,加入硝酸抑制Cu2+的水解(不引入其他杂质);答案:调节溶液的pH,使铁元素(Fe3+)完全转化为Fe(OH)3沉淀?抑制Cu2+的水解(不引入其他杂质)
本题难度:一般
5、实验题 下图是有关二氧化硫性质的实验装置图,试回答下列问题。

(1)A、C装置中发生的现象依次是__________、____________;
(2)二氧化硫具有:①漂白性;②酸性氧化物性质;③还原性;④氧化性。在图中几个装置中对应表现出的性质是(填序号)A中___________,B中___________,C中___________,D中____________;
(3)实验完毕后,将B中溶液取少量于试管中,加热,现象是___________,原因是_________________;
(4)实验完毕后,取少量D中溶液于试管中,加入BaCl2溶液和稀盐酸,现象是__________________;
(5)E中发生反应的离子方程式是__________________。
参考答案:(1)溶液变红色;溶液变浑浊或产生淡黄色沉淀
(2)②;①;④;③
(3)无色溶液变为红色;SO2与品红生成了不稳定的无色化合物,该化合物受热易分解,产生的SO2挥 发,品红又恢复原来红色
(4)产生白色沉淀
(5)SO2+2OH-=SO32-+H2O
本题解析:
本题难度:一般
| 
 ?CH3OH(g) +H2O(g)? △H ;
?CH3OH(g) +H2O(g)? △H ;