微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关金属的叙述不正确的是
A.目前我国流通的硬币是由合金材料制造的
B.铁是人体必需的元素之一,主要以二价铁的形式存在血红蛋白中
C.目前人类使用最广泛的金属材料是铝合金
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
2、选择题 下列反应不能一步完成的是
[? ]
A.Fe?→FeCl3?
B.Cu?→CuSO4?
C.Fe(OH)2?→Fe(OH)3?
D.Al2O3?→Al(OH)3
3、填空题 (16分)金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:

(2)一定温度下,氧化铁可以与一氧化碳发生如下反应:
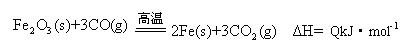
①该温度时,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,5 min后,生成了单质铁11.2 g,则这段时间内CO的反应速率为?;
②达平衡后,若温度升高,的值增大,则Q?0(填“>”、“=”、“<”)。
(3)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的。如是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol·L-1)。若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为?(填序号)。?

A.小于l? B.4左右? C.大于6? D.大于9
(4)某工业废水中含有Cu2+、Pb2+、Hg2+,若向工业废水中加入过量的FeS,当FeS、CuS、PbS和HgS共存时,溶液中c(Fe2+):c(Pb2+):c(Hg2+)=?:?:?。
已知:Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(PbS)=3.4×10-28mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2,Ksp(HgS)=6.4×10-53mol2·L-2
(5)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是?(填序号)。
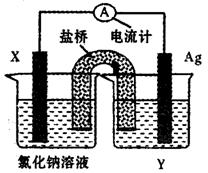
A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中
D.原电池工作时,x电极反应为:O2+2H2O+4e-→4OH-
4、填空题 若把Fe3O4看成“混合氧化物”时可以写成FeO?Fe2O3,若看成一种盐时又可以写成Fe(FeO2)2。根据化合价规则和这种书写方法,Pb3O4可以分别写作?
和?。等物质的量的Fe3O4和Pb3O4分别和浓盐酸反应时,所消耗HCl的物质的量相等,不同的是,高价的铅能将HCl氧化而放出氯气。试写出Fe3O4、Pb3O4分别和浓盐酸反应的化学方程式?,
?。
5、选择题 钠在自然界中最主要的存在形式是?(?)
A.游离态
B.氯化钠
C.硫酸钠
D.硝酸钠