微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把铁与铜的混合物放入稀硝酸中,反应后过滤,把滤出的固体物质投入盐酸中无气体放出,则滤液中一定含有的金属盐是( )
A.Cu(NO3)2
B.Fe(NO3)3
C.Fe(NO3)2
D.Fe(NO3)2和Cu(NO3)2
参考答案:由于固体投入盐酸中无气体放出,则该固体一定为铜,由反应2Fe3++Cu=2Fe2++Cu2+可知,滤液中一定不含Fe3+,故一定含有Fe2+,由于铁的还原性比铜强,故在与稀HNO3反应时,首先反应的为铁,滤液中一定含有Fe(NO3)2,若Fe完全反应后还有HNO3剩余,其还可与Cu反应产生Cu(NO3)2,若Fe与HNO3恰好反应生成Fe(NO3)2后,无HNO3剩余,则无Cu(NO3)2生成,Cu(NO3)2可能有,也可能没有.
故选:C.
本题解析:
本题难度:一般
2、选择题 下列说法中,正确的是
[? ]
A.在溶液中,H+、NO3-、Fe2+、Na+一定不能大量共存
B.化学反应过程中,一定有物质的变化,不一定有能量的变化
C.电子工业上用30%的氯化铁溶液腐蚀敷在印刷线路板上的铜箔:Fe3+ + Cu=Fe2+ + Cu2+
D.向氢氧化铁胶体中加入少量稀硫酸,因发生化学反应而产生红褐色沉淀
参考答案:A
本题解析:
本题难度:一般
3、选择题 将6g不纯锌(含杂质M)和6g不纯铁(含杂质N),分别加入到足量的稀硫酸中,反应到不再有氢气放出时,得到氢气的质量都是0.2g。则M、N可能是(?)
A.M为Mg,N为Cu
B.M为Fe,N为Al
C.M为Al,N为Na
D.N为Cu,N为Zn
参考答案:A
本题解析:考点:
分析:根据金属活动顺序镁>铝>锌>铁>氢>铜,铜不能与酸反应放出氢气;若金属中混有铜,则产生氢气量会偏小;
金属与酸完全反应放出氢气的质量可利用经验推导公式“氢气质量=  ×金属质量”求得;
×金属质量”求得;
使用以上方法,对金属中杂质甲、乙进行推断.
解答:解:根据金属完全反应放出氢气质量的计算公式:氢气质量= ×金属质量6g锌完全反应放出氢气的质量=
×金属质量6g锌完全反应放出氢气的质量=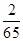 ×6g≈0.18g<0.2g,则该锌粉中的M应该是能与酸反应放出氢气的金属,且同等质量的金属甲完全反应产生氢气质量大于锌;而D选项中铜不能与酸反应产生氢气,故D不正确;而等质量的铁、铝、镁与酸完全反应放出氢气的质量都比锌大,因此,A、B、C选项都有可能是正确的;
×6g≈0.18g<0.2g,则该锌粉中的M应该是能与酸反应放出氢气的金属,且同等质量的金属甲完全反应产生氢气质量大于锌;而D选项中铜不能与酸反应产生氢气,故D不正确;而等质量的铁、铝、镁与酸完全反应放出氢气的质量都比锌大,因此,A、B、C选项都有可能是正确的;
6g铁与酸完全反应放出氢气的质量=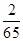 ×6g≈0.21g>0.2g,则铁粉中金属N不能与酸反应或虽是能与酸反应放出氢气但等质量的金属N完全反应放出氢气的质量小于铁;而选项B中等质量的铝完全反应放出氢气的质量大于铁,故B选项不正确;
×6g≈0.21g>0.2g,则铁粉中金属N不能与酸反应或虽是能与酸反应放出氢气但等质量的金属N完全反应放出氢气的质量小于铁;而选项B中等质量的铝完全反应放出氢气的质量大于铁,故B选项不正确;
故选A.
本题难度:简单
4、选择题 分析推理是化学学习的方法之一。下列实验推理中,正确的是(?)
A.金属的冶炼方法与金属的活泼性有很大关系,所以铁、锌等金属一般用热还原法冶炼
B.钠比铜活泼,所以钠可以从硫酸铜溶液中置换出铜
C.工业上电解熔融氯化镁可制得金属镁,所以工业上电解熔融氯化铝可制得铝
D.将镁条和铝片用导线连接后插进稀NaOH溶液中,镁条上产生气泡,说明铝比镁活泼
参考答案:A
本题解析:B项,钠比铜活泼,但将钠放入硫酸铜溶液中钠首先与水反应,不能从硫酸铜溶液中置换出铜;C项,工业上电解熔融氯化镁可制得金属镁,但熔融氯化铝不导电,所以不能用电解熔融氯化铝的方法来制取铝;D项,由于铝片能够与NaOH溶液反应,而镁条与NaOH溶液不反应,所以将镁条和铝片用导线连接再插进稀NaOH溶液,镁条为原电池正极,镁条上产生气泡,但不能说明铝比镁活泼。
本题难度:一般
5、实验题 (15分)Fe2O3俗称氧化铁红,常用作油漆着色剂。工业以煤矸石(主要成分:SiO2 49.5%;Fe2O3 20.6%;Al2O318.9%,以及MgO、FeO等其他杂质)制备并研究氧化铁红的应用。
(一)制备氧化铁红
1.预处理:将煤矸石粉碎,在350℃下焙烧2小时。
2.加酸溶解:将预处理后的煤矸石溶于质量分数为15%过量的硫酸溶液中,过滤。在滤液中加入的H2O2。
3.调节pH:在上述滤液中加1mol/LNaOH溶液调节溶液的pH,再过滤,得到滤渣。
4.产品处理:将滤渣进行水洗、烘干、煅烧、研磨、过筛得产品。
已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表
沉淀物
| Fe(OH)3
| Al(OH)3
| Fe(OH)2
| Mg(OH)2
|
开始沉淀
| 1.3
| 3.3
| 7.5
| 10.3
|
完全沉淀
| 2.8
| 5.2
| 9.7
| 12.2
|
请回答下列问题:
(1)预处理时,将煤矸石焙烧2小时的目的是?。
(2)酸浸操作中,过量H2SO4的作用是?。
在实验室中进行该操作时,用到玻璃仪器有?、?。
(3)用NaOH溶液调节pH的最佳范围是?。若从第二次过滤的滤液中获取较纯净的硫酸镁晶体,应补充的操作是?、洗涤后,干燥即得。
(4)产品处理时,对滤渣水洗的操作是 ?。
(二)分析与讨论:
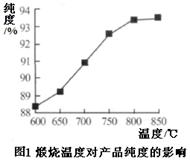
(5)产品处理时,煅烧温度对产品的纯度有很大影响。已知温度对产物纯度的影响如图1所示,则煅烧时温度最好控制在?℃。
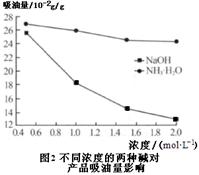
(6)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图2所示,则上述生产中在调节溶液pH时,选用NaOH溶液而不选用氨水的原因是?。
参考答案:(1)将煤矸石中的矿物转化为氧化物,便于酸浸?(2分)
(2)提高浸取率,抑制Fe3+等水解?(2分)
烧杯、玻璃棒?(各1分)
(3)2.8≤pH<3.3;(2分)?继续加碱调pH至12.2,将沉淀分离并洗净后,溶于足量稀硫酸,再蒸发(浓缩)、冷却(结晶)、过滤?(2分)
(4)加水恰好浸没滤渣,待滤尽后重复2~3次?(2分)
(5)800?(1分)
(6)用NaOH溶液,获得的氧化铁表面积小,吸油量低(2分)
本题解析:(1)将煤矸石焙烧2小时,反应充分,可将煤矸石中的矿物转化为氧化物,便于酸浸。
(2)酸浸后生成Fe2(SO4)3,所以过量H2SO4可以提高浸取率,抑制Fe3+等水解。
(3)根据表中数据,Fe3+完全沉淀时的pH为2.8,而Al3+开始沉淀时的pH为3.3,要使Fe3+完全转化为沉淀而不含杂质,调节pH的最佳范围是2.8≤pH<3.3;继续加碱调pH至12.2,Mg2+完全转化为Mg(OH)2沉淀,将沉淀分离并洗净后,溶于足量稀硫酸,再蒸发(浓缩)、冷却(结晶)、过滤,可获取较纯净的硫酸镁晶体。
(4)滤渣水洗的操作是:加水恰好浸没滤渣,待滤尽后重复2~3次。
(5)根据图1曲线,800℃时产品的纯度达到较大值,再升温,纯度升高不大,所以煅烧时温度最好控制在800℃
(6)根据图2两条曲线可知:用NaOH溶液,获得的氧化铁表面积小,吸油量低。
本题难度:一般