|
高考化学试题《热化学方程式》在线测试(2017年最新版)(六)
2017-08-10 02:45:31
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:C (s)+ O2(g)="CO(g)" H=" -110." 50KJ/mol
C (s)+O2(g)=CO2(g) H= -393.51KJ/mol
则反应C (s)+CO2(g)=" 2" CO(g)的H为
A.-283.01KJ/mol
B.+172.51 KJ/mol
C.+283.01KJ/mol
D.-504.01 KJ/mol
|
参考答案:B
本题解析:根据盖斯定律,一式×2-二式:-110.50×2+393.5=+172.51 KJ/mol,选B。
考点:考查盖斯定律的应用。
本题难度:一般
2、填空题 氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有 性,请写出工业上用氯气与NaOH溶液反应生产消毒剂NaClO的离子方程式 。
(2)棕黄色强刺激性气体Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O和NaHCO3的离子方程式 。
(3)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为 。
②ClO2遇浓盐酸会生成Cl2,每生成1 mol Cl2转移电子的物质的量为 。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为 。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。 2Cl2+2H2O,可实现氯的循环利用。
已知:①上述反应中,4 mol HCl被氧化放出115.6 kJ的热量。

则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”) 。
参考答案:(1)强氧化 Cl2+2OH- ClO-+Cl-+H2O ClO-+Cl-+H2O
(2)2Cl2+2C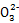 +H2O +H2O 2HC 2HC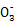 +2Cl-+Cl2O +2Cl-+Cl2O
(3)①2Cl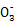 +SO2 +SO2 S S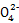 +2ClO2 ②1.6 mol ③2∶5 +2ClO2 ②1.6 mol ③2∶5
(4)31.9 强
本题解析:(2)依据信息可知Cl2+C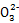 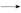 HC HC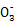 +Cl-+Cl2O,依据化合价守恒可知Cl2+C +Cl-+Cl2O,依据化合价守恒可知Cl2+C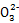 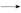 HC HC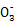 +2Cl-+Cl2O,配平除“H”、“O”之外的其他原子可得2Cl2+2C +2Cl-+Cl2O,配平除“H”、“O”之外的其他原子可得2Cl2+2C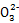 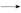 2HC 2HC +2Cl-+Cl2O,补“H2O”配“H”得2Cl2+2C +2Cl-+Cl2O,补“H2O”配“H”得2Cl2+2C +H2O +H2O 2HC 2HC +2Cl-+Cl2O,最后用“O”检查;(3)②依据化学方程式2ClO2+8HCl(浓) +2Cl-+Cl2O,最后用“O”检查;(3)②依据化学方程式2ClO2+8HCl(浓) 5Cl2↑+4H2O可知每生成5 mol Cl2转移8 mol电子;③氧化剂ClO2中氯元素的化合价降低5价,还原剂Mn的化合价升高2价,所以氧化剂与还原剂的物质的量之比为2∶5;(4)设断开1 mol H—O键与断开1 mol H—Cl 键所需能量分别为x、y,形成化学键放出的能量(4x+2×243 kJ)减断开化学键吸收的能量(4y+498 kJ)等于115.6 kJ,可得x-y="31.9" kJ 5Cl2↑+4H2O可知每生成5 mol Cl2转移8 mol电子;③氧化剂ClO2中氯元素的化合价降低5价,还原剂Mn的化合价升高2价,所以氧化剂与还原剂的物质的量之比为2∶5;(4)设断开1 mol H—O键与断开1 mol H—Cl 键所需能量分别为x、y,形成化学键放出的能量(4x+2×243 kJ)减断开化学键吸收的能量(4y+498 kJ)等于115.6 kJ,可得x-y="31.9" kJ
本题难度:困难
3、简答题 (14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
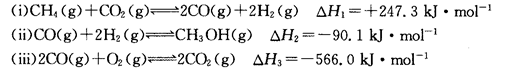
(1)用CH4和02直接制备甲醇蒸气的热化学方程式为 。
(2)某温度下,向4 L恒容密闭容器中通人6 mol C02和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为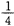 ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。 ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
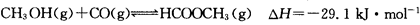 ,科研人员对该反应进行了研究,部分研究结果如下: ,科研人员对该反应进行了研究,部分研究结果如下:
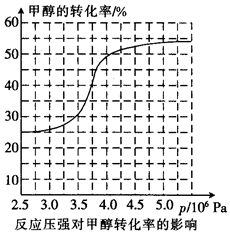 
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5× 106 Pa” “4.O×106 Pa”或“5.0× 106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:
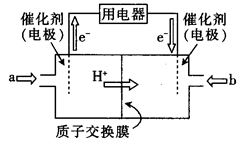
①通入a气体的电极是电池的 (填“正”或“负”)极,其电极反应式为 .
②常温下,用此电池以惰性电极电解O.5 L饱和食盐水(足量),若两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为 (忽略溶液的体积变化)。
参考答案:(1)2CH4(g)+02(g)?2CH3OH(g)△H=-251.6 kJ/mol
(2)1 33.3%
(3)①4.0×106Pa。
②80℃时速率大且高于80℃时速率变化不明显,又因为升温化学平衡逆向移动,转化率降低。
(4)①甲醇、CH3OH-6e-+H2O=CO2+6H+
②13
本题解析:(1)由盖斯定律知(i)×2+(ii)×2+(iii)得2CH4(g)+02(g)?2CH3OH(g)其△H=(+247.3kJ/mol)×2+(-90.1 kJ/mol)×2+(-566.0 kJ/mol)="-251.6" kJ/mol(2)利用三行式:设反应消耗CH4物质的量为n
CH4(g)+C02(g)?2CO(g)+2H2(g)
起始n/mol 6 6 0 0
变化n/mol n n 2n 2n
平衡n/mol 6-n 6-n 2n 2n
由题意得:2n/(12+2n)="1/4" 解得n=2mol
K=(12×12)/(1×1)=1
CO转化率为(2/6)×100%=33.3%(3)①由图可知, 3.5× 106 Pa 到4.O×106 Pa 之间甲醇转化率提高最明显,且4.0×106Pa时甲醇转化率已经较高,故工业制取甲酸甲酯选择的压强为4.0×106Pa。②图像中80℃时速率大且高于80℃时速率变化不明显,又因为该反应为放热反应升温不利反应正向进行,所以实际采用的温度是80℃。(4)①由DMFC的工作原理图示,根据电子流动方向判断a为负极通入的为甲醇。电极反应方程式为:CH3OH-6e-+2H2O=CO2+6H+②惰性电极电解O.5 L饱和食盐水,两极共生成气体0.05mol即氢气、氯气各0.025mol由反应2Cl-+2H2O=Cl2↑+H2↑+2OH-可得C(OH-)=0.05mol/0.5L=0.1mol/L所以PH=13
考点:理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。了解化学平衡常数的含义,能利用化学平衡常数进行相关计算。理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。 了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
点评:本题考查热化学方程式的书写及盖斯定律的应用、化学平衡常数的求算、利用影响化学反应速率与化学平衡的因素控制化学反应的进行,电化学方程式的书写有简单计算,考查对知识理解能力与综合运用能力。
本题难度:困难
4、选择题 符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3
⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A.①④⑤ B.①②③ C.①③④ D.①③④⑤⑥
参考答案:A
本题解析:考查盖斯定律的应用。1molS转化为为二氧化硫,需要氧气是1mol,但1molSO2转化为三氧化硫需要0.5mol氧气,②不正确;同样分析可知,1mol钠生成氧化钠是0.5mol,所以x、y的物质的量不相等,③不正确;1mol氢氧化钠生成碳酸钠是0.5mol,x、y的物质的量不相等,所以⑥不正确,因此正确的答案选A。
本题难度:一般
5、填空题 (13分)碳、硫的含量影响钢铁性能。碳、硫含量的一种测定方法是将钢样中的碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x g钢样中的碳、硫转化为CO2、SO2。
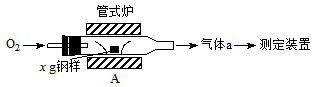
①气体a的成分是______。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2 1________+3________。 1________+3________。
(2)将气体a通入测硫装置中(如图),采用滴定法测定硫的含量。
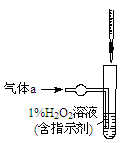
①H2O2氧化SO2的化学方程式:__________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液。若消耗1 mL NaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数:________。
(3)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:2H2(g)+O2(g)=2H2O(g) ΔH1=-d kJ·mol-1;
2C(s)+O2(g)=2CO(g) ΔH2=-e kJ·mol-1;
碳的燃烧热为f kJ·mol-1(d、e、f均大于0);
写出CO与水蒸气反应生成CO2和H2的热化学方程式:_______________________。
②将含SO2的烟气通过洗涤剂Y,再加入稀硫酸,既可以回收SO2,同时又可以得到化肥,上述洗涤剂Y可以是_______(填序号)。
a.Ca(OH)2 b.CaCl2 c.K2CO3 d.NaHSO3 e.NH3·H2O
参考答案:(1)①SO2、CO2、O2(2分) ②——1Fe3O4+3SO2(2分)
(2)①H2O2+SO2=H2SO4(2分) ②(yz)/x×100%(2分)
(3)①CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=0.5d+0.5e-f kJ·mol-1(3分)
②ce(2分)
本题解析: (1)①钢样中的碳、硫在装置A中被氧化为CO2、SO2,故a的成分为CO2、SO2以及未反应的O2;②FeS中的,-2价的硫被氧化为SO2,+2价的Fe被氧化为+3价的铁,结合所给化学计量数,可知产物应为Fe3O4和SO2,故方程式为3FeS+5O2=Fe3O4+3SO2。(2)①H2O2具有氧化性,可氧化SO2使S的化合价升高为+6价,在溶液中反应产物应为硫酸,故反应方程式为:H2O2+SO2=H2SO4;②1mL NaOH相当于yg S,故z mL NaOH相当于 zy g S,则该样品中硫的质量分数为(yz)/x×100%。(3)①碳的燃烧热化学方程式为C(s)+O2(g)=CO2(g) ΔH2=-f kJ·mol-1,根据盖斯定律,三个方程式进行加和,3式-1式÷2-2式÷2,得出ΔH=0.5d+0.5e-f kJ·mol-1,所以写热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=0.5d+0.5e-f kJ·mol-1;②碳酸钾吸收二氧化硫生成亚硫酸钾,又与硫酸反应生成二氧化硫和硫酸钾,硫酸钾可以做化肥,氨水可以吸收二氧化硫,转化为亚硫酸铵,与硫酸反应生成二氧化硫和硫酸铵,硫酸铵可以做氮肥,故选ce。
考点:本题考查碳、硫的测定原理及方法。
本题难度:困难
|