微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (10分)已知 2 mol SO2 (g) 氧化为2 mol SO3 (g) 的能量变化如图所示:

(1)写出SO2 (g) 氧化为SO3 (g) 的热化学方程式:
(2)氧化SO2时,工业上常加入V2O5作催化剂,其反应机理可表示为
SO2 + V2O5 = SO3 + 2VO2, 4VO2 + O2 = 2V2O5;
上图中表示加入V2O5的反应曲线为 (填“a”或“b”)。
(3)若在容积为2 L的密闭容器中充入2 mol SO2 (g)和1 mol O2 (g),如图甲所示,经2 min达到平衡,测得放出热量为178.2 kJ,则:

①2 min内 O2的化学反应速率v(O2)= ;
②若再充入1 mol O2重新达到平衡时,SO3平衡浓度的取值范围是: 。
(4)若将2 mol SO2 (g)和1 mol O2 (g)充入容积可变的容器乙中,初始体积为2 L,达到平衡时放出热量Q kJ,则Q 178.2 kJ(填“>”,“=”或“<”)。
参考答案:(1)2SO2(g) + O2(g)  2SO3(g),ΔH=-198 kJ/mol (2)b
2SO3(g),ΔH=-198 kJ/mol (2)b
(3)① 0.225 mol·L-1·min-1 ② 0.9mol/L<c(SO3)<1 mol/L (4)>
本题解析:(1)根据图像可知,反应是放热反应,所以热化学方程式为2SO2(g) + O2(g)  2SO3(g),ΔH=-198 kJ/mol。
2SO3(g),ΔH=-198 kJ/mol。
(2)催化剂能降低反应的活化能,但不能改变反应热,所以答案是b。
(3)①放出热量为178.2 kJ,则消耗的氧气是178.2÷198=0.9mol,所以氧气的反应速率是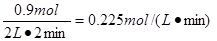 。
。
②在冲入氧气之前生成三氧化硫是1.8mol,但反应是可逆反应,所以无论冲入多少氧气,三氧化硫的物质的量不能超过2mol,所以浓度范围是0.9mol/L<c(SO3)<1 mol/L。
(4)乙是保持恒压的,又因为反应是体积减小的可逆反应,所以乙中反应物的转化率要大于甲中的,即放出的热量大于Q kJ。
本题难度:困难
2、选择题 已知A、B两种气体在一定条件下可发生反应:2A+B=C+3D+4E.现将相对分子质量为M的A气体mg与适量的B充入一个密闭容器内,恰好完全反应,有少量液滴生成,在相同的温度下测得反应前后压强分别为6.06×106和1.01×107Pa,又测得反应共放热Q?kJ,下列说法正确的是( ? )
A.D为气体
B.C为液体
C.E为气体
D.该反应的热化学方程式2A(g)+B(g)=C(g)+3D(l)+4E(g);△H=-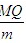 kJ/mol
kJ/mol
参考答案:C
本题解析:
本题难度:一般
3、选择题 已知C(石墨)、H2和CO的燃烧热分别为393.5kJ/mol、285.8kJ/mol和282.8kJ/mol。现有H2和CO组成的混合气体56. 0L(标准状况),经充分燃烧后,放出总热量为710.0kJ,并生成液态水。下列热化学方程式或描述中,正确的是
[? ]
A. 2CO(g)+O2(g)=2CO2(g) △H=+282.8kJ/mol
B. 2H2(g)+O2(g)=2H2O(g) △H=-571.6kJ/mol
C. C(石墨,s)+1/2O2(g)=CO(g) △H=-110.7kJ
D. 燃烧前混合气体中,H2的体积分数为40%
参考答案:D
本题解析:
本题难度:一般
4、选择题 含1 mol Ba(OH)2的稀溶液与足量稀盐酸反应,放出热量114.6 kJ。下列热化学方程式中,正确的是
[? ]
A.Ba(OH)2( aq) +2HCl( aq) =BaCl2( aq) +2H2O(l) △H= +114.6 kJ/mol
B.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l) △H= - 114.6 kJ/mol
C.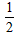 Ba(OH)2(aq) +HCl(aq)=
Ba(OH)2(aq) +HCl(aq)= BaCl2(aq) +H2O(l) △H=-57. 3 kJ/mol
BaCl2(aq) +H2O(l) △H=-57. 3 kJ/mol
D.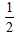 Ba(OH)2(aq) +HCl(aq)=
Ba(OH)2(aq) +HCl(aq)= 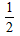 BaCl2 ( aq) + H2O(l) △H=+57.3 kJ/mol
BaCl2 ( aq) + H2O(l) △H=+57.3 kJ/mol
参考答案:BC
本题解析:
本题难度:一般
5、选择题 已知下列反应的热化学方程式为:
(1)C(s)+O2(g)=CO2(g) ΔH 1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH 2=-870.3kJ/mol
(3)H2(g)+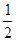 O2(g)=H2O(l) ΔH 3=-285.8kJ/mol
O2(g)=H2O(l) ΔH 3=-285.8kJ/mol
则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热ΔH为
A.+488.3 kJ/mol
B.-488.3 kJ/mol
C.-244.15 kJ/mol
D.+244.15 kJ/mol