|
|
|
高考化学必考知识点《盐类水解的原理》高频试题特训(2017年最新版)(十)
2017-08-22 14:05:07
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 Al3+ + 3H2O Al(OH)3 + 3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH值增大,应采取的措施是 Al(OH)3 + 3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH值增大,应采取的措施是
A.加热
B.加适量NaOH溶液
C.通入氯化氢气体
D.加入固体三氯化铝
|
参考答案:B
本题解析:水解吸热,加热促进水解,溶液的pH降低,A不正确;氢氧化钠能结合氢离子,降低氢离子的浓度,常见水解,B正确;C中增大氢离子的浓度,抑制水解,不正确;D中氧化铝不溶于水,对水解平衡几乎没有影响,不正确,答案选B。
考点:考查外界条件对水解平衡的影响
点评:该题是中等难度试题的考查,也是高考中的常见题型和考点。该题的关键是明确氯化铝的水解平衡特点,然后结合题意灵活运用勒夏特列原理即可,难度不大。
本题难度:一般
2、填空题 (20分)近年来大气问题受到人们越来越多的关注。按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。
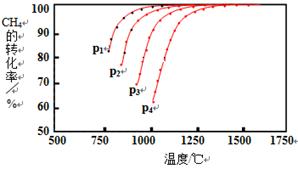
则p1、p2、p3、p4由大到小的顺序 ,该反应的正反应是______(填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K=________。
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
CH4(g)+2NO2 (g)= N2(g) + CO2(g)+2H2O(g) △H3
则△H3= ,如果三个反应的平衡常数依次为K1、K2、K3,则K3=__________(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol·L-1NaOH溶液通入SO2过程中的pH变化曲线如图所示。

①ab段发生反应的离子方程式为________________。
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为_______,如果NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则该温度下H2SO3的第一步电离平衡常数Ka=________________。
参考答案:Ⅰ.p4>p3>p2>p1;吸热,1024mol2·L-2;
Ⅱ.(1)-867kJ·mol-1;K3=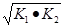
(2)①SO2+2OH-=SO32-+H2O
②c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
10-2mol·L-1
本题解析:I.由图可知,温度降低,转化率下降,则可知该反应为吸热反应,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)为体积增大的反应,压强增大,平衡逆移,故有p4>p3>p2>p1; 2CO(g)+2H2(g)为体积增大的反应,压强增大,平衡逆移,故有p4>p3>p2>p1;
CH4(g)+CO2(g) 2CO(g)+2H2(g) 2CO(g)+2H2(g)
始 5mol 5mol 0 0
转 4mol 4mol 8mol 8mol
平 1mol 1mol 8mol 8mol
平衡浓度:0.5mol/L 0.5mol/L 4mol/L 4mol/L
所以:K= =1024mol2/L2 =1024mol2/L2
II.(1)CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3
那么△H3=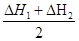 =-867kJ/mol =-867kJ/mol
因△H3=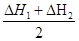 ,那么K3= ,那么K3=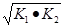
(2)向20mL0.1mol·L-1NaOH溶液通入SO2,由过程中的pH变化曲线可知。a-b段发生的反应是二氧化硫和氢氧化钠反应生成亚硫酸钠,,离子方程式为SO2+2OH-=SO32-+H2O;d点时溶液中溶质为NaHSO3,溶液显酸性,离子浓度的大小关系为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);当NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则Ka=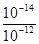 =10-2mol/L。 =10-2mol/L。
考点:反应热的计算,平衡常数的计算,离子方程式的书写,离子浓度大小的比较
本题难度:困难
3、选择题 下列各反应的化学反应方程式或离子反应方程式中,属于水解反应的是
A.CO32-+H2O HCO3-+OH- HCO3-+OH-
B.HCO3-+H2O CO32-+H3O+ CO32-+H3O+
C.CO2+H2O H2CO3 H2CO3
D.H2O+H2O H3O++OH- H3O++OH-
|
参考答案:A
本题解析:
A、为CO32-的水解方程式,故A符合题意;
B、为HCO3-的电离方程式,其水解方程式为HCO3-+H2O?OH-+H2CO3,故B不合题意;
C、为CO2与H2O反应的化学方程式,不属于水解反应,故C 不合题意;
D、为水的电离方程式,不属于水解反应,故D不合题意。
考点:水解反应、水解方程式的判断
点评:本题考查了水解反应、水解方程式的判断,难度不大。要注意水解的研究对象是盐类,而且是盐类中的弱根离子才能水解,并且CO32-的水解是分步的。
本题难度:一般
4、选择题 相同状况下,等体积的下列溶液,阴离子的总浓度最大的是
A.0.2 mol/LK2S
B.0.1 mol/LBa(OH)2
C.0.2 mol/LNaCl
D.0.2 ml/L(NH4)2SO4
参考答案:A
本题解析:
本题难度:一般
5、选择题 将0.1mol下列物质置于1L水中,充分搅拌后,溶液中阴离子数最多的是:( )
A.KCl
B.Mg(OH)2
C.Na2CO3
D.MgSO4
参考答案:C
本题解析:氢氧化镁难溶于水,阴离子数量最少。由于碳酸钠溶于水发生水解反应,方程式为CO32-+H2O HCO3-+OH-,根据方程式可知,消耗1mol阴离子,产生2mol阴离子,所以C中最多。答案选C。
HCO3-+OH-,根据方程式可知,消耗1mol阴离子,产生2mol阴离子,所以C中最多。答案选C。
考点:盐类的水解
点评:本题主要考查盐类水解的应用,但需要注意的就是如果固体难溶,则其离子在水溶液中一定最少。
本题难度:简单
 HCO3-+OH-,根据方程式可知,消耗1mol阴离子,产生2mol阴离子,所以C中最多。答案选C。
HCO3-+OH-,根据方程式可知,消耗1mol阴离子,产生2mol阴离子,所以C中最多。答案选C。