| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》答题技巧(2017年最新版)(十)
参考答案:C 本题解析:A.在NaHSO3与Na2SO3混合溶液中:根据物料守恒, c(Na+)=3c(HSO3-)+3c(SO32-)+3c(H2SO3),Na+离子的浓度最大,错误;B.0.1 mol/L的醋酸钠溶液20 mL与0.1 mol/L盐酸10 mL混合后溶液是NaCl、CH3COONa、CH3COOH等物质的量的混合溶液,由于溶液显酸性,说明:CH3COOH的电离作用大于CH3COO-的水解作用,所以c(CH3COO-)>c(CH3COOH);c(Cl-)>c(CH3COOH) ,弱酸的电离作用是微弱的,物质主要以电解质分子的形式存在所以c(CH3COOH) > c(H+),故溶液中离子浓度关系是c(CH3COO-) >c(Cl-)>c(CH3COOH) > c(H+),错误;C.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-),由于铵根离子会发生水解作用消耗水电离产生的OH-,最终使溶液显酸性,所以c(SO42-)>c(NH4+), c(H+)>c(OH-)。但是盐的水解作用是微弱的,主要以盐的离子的形式存在,所以c(NH4+)>c(H+),因此溶液中两种浓度关系是c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),正确;D.向1.00 L 0.3 mol/LNaOH溶液中缓慢通入0.2 mol CO2气体,会发生反应CO2+2NaOH=Na2CO3+H2O NaOH +CO2 =NaHCO3 根据Na元素守恒可得2n(Na2CO3)+n(NaHCO3)=0.3ml;根据C元素守恒可得n(Na2CO3)+n(NaHCO3)=0.2mol,解得n(Na2CO3)=n(NaHCO3)=0.1mol。由于Na2CO3水解程度大于NaHCO3,所以c(HCO3-)>c(CO32-),二者水解是显碱性,所以c(OH-)>c(H+),但是盐的水解程度是微弱的,主要以盐的离子存在,所以c(CO32-)> c(OH-)。故溶液中离子浓度大小关系是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),错误。 本题难度:一般 2、选择题 将0.5mol的下列物质溶于500ml水中,,含阴离子数目最多的是 |
参考答案:D
本题解析:略
本题难度:一般
3、选择题 设NA为阿伏加德罗常数,下列说法正确的是
A.1L 0.1mol/L的Na2CO3溶液中,含Na+0.2 NA个,CO32-0.1 NA个
B.1L 0.3mol/L的K2SO4溶液中,含K+和SO42-离子总数为0.9 NA个
C.2L 0.6mol/L的Fe2(SO4)3溶液中,含SO42-离子总数为2.4 NA个
D.0.1mol/L的H3PO4溶液中,c(H+)∶c(PO43-)<3∶1
参考答案:B
本题解析:A. 1L 0.1mol/L的Na2CO3溶液中,含Na+0.2 NA个,CO32-因水解小于0.1 NA个,错误;B. 1L 0.3mol/L的K2SO4溶液中,含K+和SO42-离子总数为0.9 NA个,正确;C. 2L 0.6mol/L的Fe2(SO4)3溶液中,含SO42-离子总数为3.6 NA个,错误;D. 0.1mol/L的H3PO4溶液中,磷酸是三元弱酸,c(H+)∶c(PO43-)>3∶1,错误;选B。
考点:考查阿伏伽德罗常数的计算。
本题难度:一般
4、选择题 将0.1mol/L的醋酸钠(NaAc)溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是 ( )
A.c(Ac-)>c(Cl-)>c(H+)>c(HAc)
B.c(Ac-)>c(HAc)>c(Cl-)>c(H+)>c(OH-)
C.c(Ac-)=c(Cl—)>c(H+)>c(HAc)
D.c(Na+)+ c(H+)=c(Ac-)+ c(Cl-)+ c(OH-)
参考答案:D
本题解析:将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,反应后NaAc和HAc的物质的量相等,溶液显酸性,说明HAc电离程度大于Ac-水解程度,A.HAc为弱电解质,部分电离,应有c(HAc)>c(H+),A错误;B.溶液遵循电中性原则,应有c(Na+)+c(H+)=c(Ac-)+c(Cl-)c+(OH-),B错误;C.反应后NaAc和HAc的物质的量相等,溶液显酸性,说明HAc电离程度大于Ac-水解程度,则(Ac-)>c (Cl-),C错误;D.反应后NaAc和HAc的物质的量相等,溶液显酸性,说明HAc电离程度大于Ac-水解程度,则(Ac-)>c (Cl-),HAc为弱电解质,部分电离,应有c(HAc)>c(H+),D正确。
考点:考查离子浓度大小的比较,弱电解质在水溶液中的电离平衡,盐类水解的应用。
本题难度:一般
5、选择题 已知酸H2B在水溶液中存在下列关系:①H2B = H++HB—,②HB—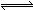 H++B2—,则下列说法中一定正确的是
H++B2—,则下列说法中一定正确的是
A.NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
B.Na2B溶液一定呈碱性,NaHB溶液可能呈酸性也可能呈碱性
C.NaHB水溶液中一定有:c(Na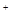 )+c(H
)+c(H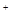 )=c(HB
)=c(HB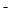 )+c(OH
)+c(OH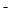 )+c(B
)+c(B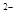 )
)
D.在Na2B溶液中一定有:c(OH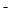 )=c(H
)=c(H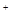 )+c(HB
)+c(HB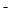 )
)
参考答案:AD
本题解析:
正确答案:AD
A.正确,NaHB不水解,溶液一定呈酸性,Na2B水解,溶液一定呈碱性
B.不正确;
C.不正确,NaHB水溶液中一定有:电荷守恒应为c(Na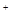 )+c(H
)+c(H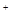 )=c(HB
)=c(HB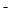 )+c(OH
)+c(OH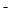 )+2c(B
)+2c(B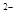 )
)
D.正确,在Na2B溶液中存在质子守恒,一定有:c(OH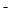 )=c(H
)=c(H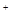 )+c(HB
)+c(HB )
)
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《气体的净化.. | |