|
|
|
高考化学知识点总结《盐类水解的原理》答题技巧(2017年最新版)(七)
2017-08-22 14:27:13
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法正确的是 HCO3-+OH-。下列说法正确的是
A.稀释溶液,水解平衡常数增大
B.通入CO2,平衡向正反应方向移动
C.升高温度,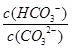 减小 减小
D.加入NaOH固体,溶液pH减小
|
2、选择题 下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.0.1mol·L-1 NaHCO3溶液中:c(H+)+2c(H2CO3)=2c(CO32-)+c(OH-)
B.0.1mol·L-1(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
C.将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-)
D.pH相等的①CH3COONa、②C6H5ONa、③Na2CO3、④NaOH四种溶液的物质的量浓度大小:①>②>③>④
|
3、填空题 (共14分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
编号
| HA物质的量浓度(mol·L-1)
| NaOH物质的量浓度(mol·L-1)
| 混合溶液的pH
|
①
| 0.1
| 0.1
| pH=9
|
②
| c
| 0.2
| pH=7
|
③
| 0.2
| 0.1
| pH<7
|
请回答:
(1)从①组分析,HA是
酸(填强或弱)。所得混合溶液由水电离出c(OH-) =
mol·L-1。
(2)②组表明,c
0.2(选填“>、=或 <”)。
该混合液中离子浓度c(A-)与c(Na+)的大小关系是
。(选填“>、=或 <”)
(3)从③组分析,说明此时HA电离程度
NaA水解程度(选填“>、=或 <”)。
该混合溶液中各离子浓度由大到小的顺序是
。
(4)由上述所涉及的溶质组成以下四组等体积溶液:
甲:0.1mol/LNaA; 乙:0.1mol/LNaA和0.1mol/LHA;
丙:0.1mol/LHA; 丁:0.1mol/LNaA和0.1mol/LNaOH;
则A-离子浓度由大到小的顺序为
>
>
>
。(填写序号)
4、选择题 下列各离子方程式中,属于水解反应且使溶液显碱性的是( )
A.CH3COOH+OH-═CH3COO-+H2O
B.H2O+H2O?H3O++OH-
C.NH4++H2O?NH3?H2O+H+
D.PO43-+H2O?HPO42-+OH-
5、选择题 下列关系的表述中,正确的是
A.0.1mol·L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)
B.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1
C.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等
D.0.1mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)