微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (创新预测题)已知25 ℃时弱电解质的电离平衡常数:
Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。
(1)将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与0.10 mol·L-1的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与
时间t的关系如图所示。
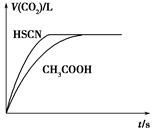
反应开始时,两种溶液产生CO2的速率明显不同的原因是________;反应结束后所得溶液中c(SCN-)______c(CH3COO-)(填“>”、“=”或<)。
(2)2.0×10-3 mol·L-1的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示。则25 ℃时,HF电离平衡常数为Ka(HF)=________(列式求值)。
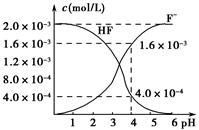
(3)难溶物质CaF2溶度积常数为Ksp=1.5×10-10,将4.0×10-3 mol·L-1 HF溶液与4.0×10-4 mol·L-1的CaCl2溶液等体积混合,调节溶液pH=4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?________(填“有”或“没有”),简述理由:_____________________________________。
2、选择题 在C(HCO3-)="0.1" mol·L-1的溶液中, 可以大量共存的离子组是(? )?
A.Ca2+、NO3-、NH4+、Cl?
B.Na+、SO42-、C1?、Ca2+
C.H+、Ba2+、Cl?、NO3-
D.Cl?、CO32?、Na+、OH-
3、选择题 下列各组离子中,在给定条件下能大量共存的是
A.在pH = 1的溶液中:NH4+、K+、ClO-、Cl-
B.有SiO32-存在的溶液中:Na+、Mg2+、Al3+、Cl-
C.有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+ 、Br-
D.在c(H+) = 1.0×10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-