微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是
A.1 molH3PO4的质量为98 g·mol-1
B.H3PO4的摩尔质量为98 g
C.9.8 gH3PO4含有Na个H3PO4分子
D.Na个H3PO4分子的质量为98 g
参考答案:D
本题解析:剖析A中质量的单位为g;B中摩尔质量的单位为g·mol-1;C中含有的磷酸的分子数为0.1NA.
规律总结摩尔质量在数值上等于该物质的相对原子质量或相对分子质量,单位为g·mol-1;1 mol某物质的质量在数值上也等于该物质的相对原子质量或相对分子质量,单位为g,掌握摩尔质量、物质的量、物质的质量三者之间的关系.
本题难度:困难
2、选择题 下列叙述中,指定粒子的数目约为6.02×1023的是
A.1.6?g?CH4中含有的电子数
B.1?mol/L的稀硫酸100?mL中含有H+的数目
C.24?g金属镁与足量的盐酸反应转移的电子数
D.标准状况下,22.4?L?H2和CO混合气体中的原子数
参考答案:A
本题解析:分析:A.1个CH4中含有10个电子;
B.根据物质的量浓度公式计算;
C.1mol金属镁转移2mol电子;
D.根据分子数求算.
解答:A.1个CH4中含有10个电子,故1.6 g CH4中含有的电子为1mol,故电子数目约为6.02×1023,故A正确;
B.根据物质的量浓度公式:n(硫酸)=c?v=1 mol/L×0.1L=0.1mol,所以n(H+)=0.2mol,故B错误;
C.1mol金属镁转移2mol电子,所以24 g金属镁与足量的盐酸反应转移的电子为2mol,故C错误;
D.标准状况下,22.4 L H2和CO混合气体分子为1mol,因为二者为双原子分子,故原子为2mol,故D错误;
故选A.
点评:本题考查了阿伏伽德罗常数的有关问题,注意物质与微粒的关系,注意气体摩尔体积的运用,题目较简单.
本题难度:一般
3、填空题 选择下列实验方法分离物质,将分离方法的序号填在横线上.
A.萃取分液?B.升华?C.结晶?D.分液?E.蒸馏?F.过滤
(1)分离饱和食盐水与沙子的混合物______;
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾______;
(3)分离水和汽油的混合物______;
(4)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体______;
(5)从碘水中提取碘单质______.
参考答案:(1)饱和食盐水与沙子的混合物为不溶物与液体的分离,可利用过滤法分离,故答案为:F;
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾为可溶性固体之间的分离,且二者的溶解度受温度的影响不同,可利用结晶法分离,故答案为:C;
(3)水和汽油二者不互溶,分层,可利用分液法分离,故答案为:D;
(4)酒精和甲苯二者互溶,但沸点不同,利用沸点的差异来分离,即采用蒸馏法分离,故答案为:E;
(5)碘在水中的溶解度比在有机物中的溶解度小,选择萃取剂来分离,即选择萃取分液法分离,故答案为:A.
本题解析:
本题难度:一般
4、实验题 某研究性学习小组的同学想通过下图实验装置探究SO2与Na2O2反应的产物。(夹持装置已略去,装置的气密性良好)

Ⅰ.实验中装置B可吸收水分,干燥SO2气体,其目的是:_________________________。
装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是:_________________。
Ⅱ.对C中固体产物提出如下假设:(假设Na2O2已全部反应)
假设1:__________。 假设2:只有Na2SO4; 假设3:既有Na2SO3又有Na2SO4。
(1)甲同学认为SO2与Na2O2的反应不同于CO2,应为假设2成立,请据此写出C中所发生反应的化学方程式:_____________________。
(2)若假设2成立,为确定C中固体产物的成分,甲同学设计如下实验:

得出结论:C中固体产物只有Na2SO4。该方案是否合理?答:__________。(填“是”或“否”)理由是______________________________。
(3)乙同学为证明假设3成立,设计如下实验。
实验步骤和结论为:
①取少量C中固体产物于试管中,加入适量的蒸馏水溶解;
②滴加过量的1mol?L-1BaCl2溶液,若产生白色沉淀,则证明C中固体产物中有_________;
③滴加适量的1mol?L-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,则证明C中固体产物中有___________________。
参考答案:Ⅰ.防止水蒸气与Na2O2反应,防止空气中的水和CO2进入玻璃管C。
Ⅱ.假设1:只有Na2SO3
(1)SO2+Na2O2=Na2SO4。(2)否;NO3-在酸性条件下可将BaSO3氧化成BaSO4
或硝酸根在酸性条件下具有强氧化性
(3)②Na2SO3和Na2SO4至少有一种;(2分)
③既有Na2SO3又有Na2SO4。(2分)
本题解析:Ⅰ、A装置中产生的二氧化硫气体中含有水蒸气,水能和过氧化钠反应生成氢氧化钠和氧气,B装置中浓硫酸具有吸水性,可吸收水蒸气;空气中含有二氧化碳和水蒸气,碱石灰是干燥剂,所以能吸收水分,防止水蒸气的干扰;碱石灰能和二氧化碳反应,防止二氧化碳的干扰,所以装置D的作用是防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应;Ⅱ、根据题给信息知,假设1:只有Na2SO3;?(1)若假设2成立,二氧化硫和过氧化钠反应的方程式为:Na2O2+SO2=Na2SO4?;(2)硝酸有强氧化性,能把亚硫酸根离子氧化成硫酸根离子,所以该方案不合理;(3)乙同学为证明假设3成立,设计如下实验。实验步骤和结论为:①取少量C中固体产物于试管中,加入适量的蒸馏水溶解;②滴加过量的1mol?L-1BaCl2溶液,若产生白色沉淀,由于硫酸钡和亚硫酸钡均为不溶于水的白色固体,则证明C中固体产物中Na2SO3和Na2SO4至少有一种;③滴加适量的1mol?L-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,则证明C中固体产物中既有Na2SO3又有Na2SO4。
本题难度:一般
5、选择题 工业上制备氯化铜时,是将浓盐酸用蒸汽加热至80?℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下

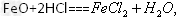
已知:? 时,
时,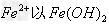 ?形式完全沉淀;?
?形式完全沉淀;?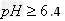 时,?
时,?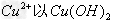 形式完全沉淀;pH在3.4时,
形式完全沉淀;pH在3.4时,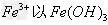 形式完全沉淀。除去溶液中的Fe2+可以采用的方法是
形式完全沉淀。除去溶液中的Fe2+可以采用的方法是
[? ]
A.直接加碱,调整溶液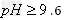
B.加纯铜粉,将Fe2+还原出来?
C.先将Fe2+氧化成Fe3+再调整pH至3.4
D.通入硫化氢,使Fe2+直接沉淀?
参考答案:C
本题解析:
本题难度:一般