| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《水的电离平衡》试题特训(2017年最新版)(二)
参考答案:C 本题解析:Kw≠10-14,pH=7的溶液不呈中性,Kw=10-12,pH=6的溶液显中性,所以A、B、D都错误,C正确。答案选C 本题难度:一般 3、选择题 甲、乙、丙、丁、戊五种溶液的溶质分别是HCl、CH3COOH、NaOH、NH3·H2O、Na2CO3中的一种。常温下如下实验:①将0.1 L pH=9的甲溶液分别与a L 0.001 mol/L的乙溶液、b L 0.001 mol/L的丁溶液充分反应后溶液呈中性时,a>b;②浓度均为0.1 mol/L的丙和丁溶液等体积混合后,溶液呈酸性;③0.1 mol/L的甲溶液pH小于0.1 mol/L的戊溶液pH。下列判断正确的是 |
参考答案:B
本题解析:略
本题难度:一般
4、填空题 (18分)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验I:制取NaClO2晶体
己知:NaClO2饱和溶液在温度低于38℃时析出品体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。
(1)装置③的作用是 装置①的作用是
(2)装置②中制备ClO2的化学方程式为 ;产生ClO2的还原剂是装置④中制备NaClO2的化学方程式为
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶:②趁热过滤;③ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:①准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为
(5)该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果 (填“偏高”或“偏低”),原因用离子方程式表示为 。
参考答案:(1)防止倒吸;吸收装置中未反应的ClO2 ,防止外逸污染空气;
(2)Na2SO3+2NaClO3+H2SO4= 2Na2SO4+ 2ClO2↑+H2O; Na2SO3;
2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑(2分) ;
(3)用38 ℃~60 ℃的温水洗涤;(4)溶液由蓝色变为无色且半分钟不变色
(5)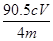 % 或 22.6Cv/m% (2分),(6)偏高 4I-+O2+4H+=2I2+2H2O (2分)
% 或 22.6Cv/m% (2分),(6)偏高 4I-+O2+4H+=2I2+2H2O (2分)
本题解析:(1)在装置②中发生反应制取ClO2,在装置④中气体进行反应,使装置内压强降低,装置③防止倒吸现象的发生;装置①中含有NaOH溶液,可以与ClO2,发生反应,因此其作用是吸收装置中未反应的ClO2 ,防止外逸污染空气;(2)在装置②中发生反应制取ClO2,根据电子守恒和质量守恒定律可得:Na2SO3+2NaClO3+H2SO4= 2Na2SO4+ 2ClO2↑+H2O。在该反应中Na2SO3中的S元素的化合价升高,失去电子,作还原剂;在装置④ClO2与NaOH的H2O2溶液发生氧化还原反应,产生反应后的溶液获得NaClO2晶体,在该反应中Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,根据电子守恒、原子守恒可得方程式为: 2NaOH+ 2ClO2+ H2O2= 2NaClO2+2H2O+O2,(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2·3H2O,应趁热过滤,由题目信息可知,应该控制温度38℃~60℃进行洗涤,低于60℃干燥;(4)碘单质遇淀粉变蓝色,反应结束时,碘反应完全,所以滴加最后一滴Na2S2O3标准液时,溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;(5)令样品中NaClO2的质量分数为a,根据反应方程式:ClO2-+4I-+4H+=2H2O+2I2+Cl-;I2+2S2O32-=2I-+S4O62-可得关系式:NaClO2~2I2~4S2O32-。则NaClO2与S2O32-的关系是每90.5g NaClO2对应消耗 4mol 的S2O32-。n(S2O32-)=" c" mol·L-1×V×10-3L×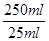 ,则m(NaClO2)=
,则m(NaClO2)= 。所以NaClO2的纯度是a= [m(NaClO2)÷m(总)]×100=
。所以NaClO2的纯度是a= [m(NaClO2)÷m(总)]×100=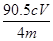 %=22.6Cv/m%。(6)(6)在滴定操作正确无误的情况下,由于反应过程会产生氧气,氧气会将溶液中的I-氧化为I2单质,使溶液中碘的含量偏高,滴定消耗的Na2S2O3标准液体积偏高,故会使实验测得结果偏高。反应离子方程式为4I-+O2+4H+=2I2+2H2O。
%=22.6Cv/m%。(6)(6)在滴定操作正确无误的情况下,由于反应过程会产生氧气,氧气会将溶液中的I-氧化为I2单质,使溶液中碘的含量偏高,滴定消耗的Na2S2O3标准液体积偏高,故会使实验测得结果偏高。反应离子方程式为4I-+O2+4H+=2I2+2H2O。
考点:考查物质制取过程中装置的作用、物质制取原理的方程式表示、滴定终点的判断、误差分析、关系式法在物质纯度的计算中的作用的知识。
本题难度:一般
5、选择题 室温下,等物质的量浓度的下列溶液中,水的电离程度大小的正确排列顺序是
①NH4Cl ②NaCl ③KNO3 ④NaOH
A.①>④>②=③
B.④>②=①>③
C.①>②=③>④
D.②>③>①>④
参考答案:C
本题解析:①NH4Cl是强酸弱碱盐,NH4+水解,促进水的电离;②NaCl是强酸强碱盐,对水的电离无影响;③KNO3是强酸弱碱盐,对水的电离无影响;④NaOH是强碱,电离出的OH-对水的电离起抑制作用。水的电离程度大小顺序:①>②=③>④
考点:考查影响水电离的因素。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《醇》高频试.. | |