微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-)
C.已知Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者
D.浓度均为0.1 mol·L-1的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:③>②>①
参考答案:BC
本题解析:A.NH4Cl是强酸弱碱盐,水解溶液呈酸性,正确的是c(Cl-)>c(NH4+)>c(H+)>c(OH-),错误;B.将醋酸钠、盐酸两溶液混合后,根据电苛守恒,c(Na+)+c(H+)=c(Cl-)+c(AC-)+c(OH-),溶液呈中性,c(H+)=c(OH-),化简得c(Na+)=c(Cl-)+c(AC-),所以混合后的溶液中:c(Na+)>c(Cl-),正确。C.由Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,可知HCN酸性更弱,等体积等浓度的NaF、NaCN溶液中,NaCN溶液的碱性强,即氢氧根离子浓度大,根据电苛守恒,两都的钠离子浓度相等,但NaCN中的氢离子浓度小,故前者离子总数大于后者,错误;D.①(NH4)2CO3中铵根和碳酸根都能发生水解,相互促进,铵根浓度最小。②(NH4)2SO4硫酸根不会对铵根离子的水解产生影响。③(NH4)2Fe(SO4)2中二价铁离子水解呈酸性抑制铵根的水解,铵根离子浓度最大。c(NH4+)的大小顺序为:③>②>①。正确。
本题难度:一般
2、选择题 下列离子方程式正确的是(?)
A.Na2CO3溶液的水解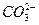 +2H2O
+2H2O H2CO3+2OH-
H2CO3+2OH-
B.金属铝溶于氢氧化钠溶液 Al+2OH-
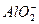 +H2↑
+H2↑
C.铜与浓硝酸反应 3Cu+8H++2
 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
D.次氯酸钙溶液中通入过量CO2 ClO-+CO2+H2O====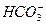 +HClO
+HClO
参考答案:D
本题解析:A中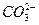 水解应分两步写。B项金属铝溶于氢氧化钠溶液的离子方程式为:2Al+2OH-+2H2O====
水解应分两步写。B项金属铝溶于氢氧化钠溶液的离子方程式为:2Al+2OH-+2H2O==== +3H2↑。C项铜与浓硝酸反应的离子方程式为Cu+4H++2
+3H2↑。C项铜与浓硝酸反应的离子方程式为Cu+4H++2 ?====Cu2++2NO2↑+2H2O。
?====Cu2++2NO2↑+2H2O。
本题难度:简单
3、选择题 实验室为标定一种烧碱样品的物质的量浓度,称取该烧碱样品4.0g配成1L溶液,取出20.00mL置于锥形瓶中,用0.10 mol·L-1 HCl标准溶液滴定,恰好完全中和时消耗标准盐酸19.00mL,若烧碱中只含有一种杂质,则不可能是(?)
A.NaCl
B.Ca(OH)2
C.Na2CO3
D.NaHCO3
参考答案:B
本题解析:此题考的是滴定中的计算问题,属于中等难度题型。
若没有杂质则n(样品)=2﹡10-3mol。 n(HCl)="C(HCl)*V(HCl)=0.10" mol·L-1 *0.019L=1.9﹡10-3mol>2﹡10-3mol,如果杂质不与盐酸反应则A正确,如果杂质能与盐酸反应,可用极值法计算,设样品全都是杂质计算求出1L溶液中杂质的质量。0.019mol盐酸中和Ca(OH)2?的质量为?0.7g ,则1L溶液含Ca(OH)2?3.5g。同理可求得Na2CO3 为5.035g,NaHCO3 为7.98g。只有当杂质的质量小于4.0g时才符合题意,因此不可能是B选项。
本题难度:简单
4、选择题 下列有关判断正确的是( )
A.0.1 mol·L-1Na2SO3溶液中有c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)
B.0.1 mol·L-1NH4Fe(SO4)2溶液中离子浓度大小关系为c(SO42-)>c(Fe3+)=c(NH4+)>c(H+)>c(OH-)
C.0.2 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合后有c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合得到的溶液一定呈酸性
参考答案:C
本题解析:SO32-发生水解,则由物料守恒可得c(Na+)
=2c(SO32-)+2c(HSO3-)+2c(H2SO3),A错误;NH4Fe(SO4)2溶液中,Fe3+、NH4+的水解能力不同,故c(NH4+)不等于c(Fe3+),B错误;依据电荷守恒可知C正确;题给两种溶液混合后得到等浓度的NaA和HA溶液,若HA的电离程度小于A-的水解程度,则溶液呈碱性,D错误。
本题难度:一般
5、选择题 下列叙述正确的是(设NA为阿伏加德罗常数的数值)
A.检验溶液中是否含有Fe2+的方法是先滴加氯水,再滴加KSCN溶液
B.铅蓄电池放电时的负极反应式为:PbO2+4H++SO42一+2e一=PbSO4+2H2O
C.Na2CO3溶液加水稀释后,恢复至原温度,溶液的pH和Kw均减小
D.某电池的总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,每生成lmolNa2Mn5O10转移电子数2NA
参考答案:D
本题解析:A、亚铁离子具有还原性,所以检验溶液中是否含有Fe2+的方法是先滴加KSCN溶液无现象,再滴加氯水,溶液变成红色,A不正确;B、原电池中负极失去电子,正极得到电子,所以铅蓄电池放电时的正极反应式为PbO2+4H++SO42一+2e一=PbSO4+2H2O。负极反应式为Pb-2e-+SO42-=PbSO4,B不正确;C、碳酸钠溶于水CO32-水解,溶液显碱性。稀释促进水解,但溶液的pH降低。温度不变,Kw不变,C不正确;D、根据反应式可知,二氧化锰是氧化剂,银是还原剂,化合价从0价升高到+1价,所以每生成lmolNa2Mn5O10转移电子数2NA,D正确,答案选D。
本题难度:一般