微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液在空气中加热、蒸干、灼烧后,所得固体为原溶液中的溶质的是(?)
A.NaHCO3
B.KMnO4
C.FeCl3
D.NaCl
参考答案:D
本题解析:NaHCO3、KMnO4灼烧易分解,FeCl3溶液蒸干得Fe(OH)3,灼烧分解生成Fe2O3。
本题难度:一般
2、填空题 (1)AgNO3的水溶液呈?(填“酸”、“中”、“碱”)性,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度.以?(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈?性,原因是(用离子方程式表示):_____________________
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是?
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的??。原因是:_________________(用离子方程式表示);
参考答案:(1)酸,抑制。(2)酸,Al3++3H2O 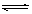 ?Al(OH)3+3H+, Al2O3?;
?Al(OH)3+3H+, Al2O3?;
(3)NaOH。S2-+H2O HS-+OH-?HS-+H2O
HS-+OH-?HS-+H2O H2S+OH-
H2S+OH-
本题解析:(1)硝酸银是强酸弱碱盐,所以AgNO3的水溶液呈酸性;硝酸中氢离子浓度大,所以将AgNO3固体先溶于较浓的硝酸中,可以抑制硝酸银的水解。
(2)氯化铝是强酸弱碱盐,水解显酸性,反应的方程式是Al3++3H2O 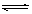 ?Al(OH)3+3H+;由于水解是吸热的,所以加热可以促进水解,同时生成的氯化氢极易挥发,所以最终生成的是氢氧化铝,灼烧得到氧化铝。
?Al(OH)3+3H+;由于水解是吸热的,所以加热可以促进水解,同时生成的氯化氢极易挥发,所以最终生成的是氢氧化铝,灼烧得到氧化铝。
(3)硫化钠是强碱弱酸盐,硫离子水解显碱性,所以加入少量的氢氧化钠可以抑制硫化钠的水解,有关反应的方程式是S2-+H2O HS-+OH-?、HS-+H2O
HS-+OH-?、HS-+H2O H2S+OH-。
H2S+OH-。
点评:在判断盐溶液的酸碱性时,需要掌握盐类水解的原理及水解的特点。盐类水解遵循:有弱才水解、无弱不水解、都弱都水解,越弱越水解,谁强显谁性。
本题难度:一般
3、选择题 常温下,下列有关叙述正确的是
A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol/L
C.pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序①>②>③
D.10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH=7,所得溶液体积V(总)≥20mL
参考答案:B
本题解析:根据原子守恒可知c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),A不正确。NaB溶液的pH=8,说明B-水解显碱性,c(H+)=10-8mol/L,则c(OH-)=10-6mol/L。根据电荷守恒c(Na+)+c(H+)= c(OH-)+c(B-)可知,选项B是正确的。NH4+水解显酸性,c(NH4+)越大,酸性越强,所以当pH相等时,氯化铵和硫酸铵溶液中NH4+浓度是相同的。由于NH4HSO4能电离出大量的氢离子,所以该溶液中NH4+浓度最小,C也不正确。若HA是强酸,则二者恰好反应时,溶液显中性,需要HA的体积是10ml。若HA是弱酸,则pH=2的HA,其HA的浓度大于0.01mol/L。若消耗10mlHA,则HA一定是过量的,溶液显酸性。所以要使溶液显中性,则HA的体积必须小于10ml,因此D也是错误的。答案选B。
本题难度:一般
4、选择题 下列水解离子方程式正确的是
A.醋酸钠:CH3COOˉ+ H2O = CH3COOH + OHˉ
B.硫化钾:S2ˉ+ 2H2O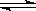 H2S +2 OHˉ
H2S +2 OHˉ
C.氯化铵: NH4+ + H2O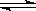 NH3·H2O + H+
NH3·H2O + H+
D.硫酸铁:Fe3+ +3 H2O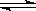 Fe(OH)3↓+3 H+
Fe(OH)3↓+3 H+
参考答案:C
本题解析:A错,正确为:CH3COOˉ+ H2O? CH3COOH + OHˉ;B错,正确为:S2ˉ+? H2O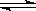 HS —+OHˉ;C正确;D错,正确为:Fe3+ +3 H2O
HS —+OHˉ;C正确;D错,正确为:Fe3+ +3 H2O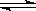 Fe(OH)3+3 H+;
Fe(OH)3+3 H+;
本题难度:简单
5、选择题 下列有关问题,与盐的水解有关的是
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②明矾可作净水剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液并灼烧得到Al2O3固体
A.①②③
B.②③④
C.①④⑤
D.①②③④⑤
参考答案:D
本题解析:①NH4Cl与ZnCl2都是强酸弱碱盐,水解使溶液显酸性,所以溶液可以与金属氧化物发生反应。因此可作焊接金属中的除锈剂。②明矾电离产生的Al3+水解产生氢氧化铝胶体表面积大,吸附力强可吸附水中的悬浮物,形成沉淀,从而可以达到净化水的目的。故可作净水剂。正确。③草木灰的主要成分是K2CO3,水解使溶液显碱性。当它与铵态氮肥混合时发生反应:NH4++OH-=NH3·H2O= NH3↑+H2O。若混合施用,就会使一部分N元素以氨气的形式逸出导致肥效降低。正确。④碳酸钠是强碱弱酸盐,水解使溶液显碱性。实验室盛放碳酸钠溶液的试剂瓶若用磨口玻璃塞就会发生反应:SiO2+2NaOH= Na2SiO3+H2O. Na2SiO3有粘性,会把玻璃瓶和玻璃塞黏在一起。正确。⑤AlCl3是强酸弱碱盐,水解使溶液显酸性,当加热AlCl3溶液时水解产生氢氧化铝和盐酸,随着不断的加热,水分蒸发,HCl也会随着水分的蒸发而挥发掉。所以蒸干得到的固体是氢氧化铝。灼烧时氢氧化铝分解得到Al2O3固体和水。所以加热蒸干AlCl3溶液并灼烧得到Al2O3固体。正确。
本题难度:一般