| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《难溶电解质的溶解平衡》试题特训(2017年最新版)(二)
参考答案:A 本题解析:A、负极的电极方程CH4O+3O2--6e-=CO2+2H2O,则当原电池中有0.5 mol甲醇消耗时,负极消耗O2-的物质的量为1.5mol,故A正确;B、由表达式可知,该密度= 本题难度:一般 2、填空题 某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀,从而将其除去的可能性,查得如下资料:(以下数据和实验均指在25℃下测定)
实验步骤如下: ①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。 ②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液. ③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液. ④向沉淀中加入足量的盐酸。 (1)步骤①所得悬浊液中[Ca2+]=________ mol·L-1 (2)写出第②步发生反应的离子方程式:________________________________. (3)设计第③步的目的是________________________________________________. (4)第④步操作发生的现象为: 。 参考答案:(1)0.003 本题解析:步骤①产生白色沉淀,确定为CaSO4,根据其Ksp解得[Ca2+] =0.003 mol/L;结合两者的溶度积确定当加入固体Na2CO3时,产生CaCO3,确定②的离子方程式为CO32- (aq)+CaSO4(s)=SO42- (aq)+CaCO3(s) 。 本题难度:困难 3、选择题 把Ca(OH)2放入蒸馏水中,一段时间后达到如下平衡: 参考答案:C 本题解析:A、恒温下向溶液中加入CaO,CaO与水反应生成氢氧化钙,溶液中有氢氧化钙沉淀生成,溶液仍为饱和溶液,氢氧化钙的浓度不变,pH不变,错误;B、Ca(OH)2的溶解度随温度的升高而降低,给溶液加热,有氢氧化钙沉淀析出,氢氧化钙的浓度减小,溶液pH减小,错误;C、向溶液中加入Na2CO3溶液,发生Ca2++CO32-=CaCO3↓,其中固体质量增加,正确;D、向溶液中加入少量NaOH固体,溶液中氢氧根浓度增大,平衡逆向移动,Ca(OH)2固体质量增加,错误。 本题难度:一般 4、选择题 ①已知t℃时AgCI的Ksp=2×10-10;②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是 |
参考答案:D
本题解析:A、依据图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s) 2Ag+CrO42-,Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-6=10-12,故A错误;B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故B错误;C、依据溶度积常数计算Ksp(CrO42-)=c2(Ag+)c(CrO42-)=1×10-12;Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,以0.01mol/L AgNO3溶液滴定20mL0.01mol/L KCl和0.01mol/L的K2CrO4的混合溶液,c(CrO42-)=0.01mol/L,得到c(Ag+)=10-12÷0.01=10-5mol/L,0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依据溶度积计算得到:c(Ag+)=2×10?10÷0.01=2×10-8mol/L,所以先析出氯化银沉淀,故C错误;D、在t℃时,反应Ag2CrO4(s)+2Cl-(aq)
2Ag+CrO42-,Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-6=10-12,故A错误;B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故B错误;C、依据溶度积常数计算Ksp(CrO42-)=c2(Ag+)c(CrO42-)=1×10-12;Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,以0.01mol/L AgNO3溶液滴定20mL0.01mol/L KCl和0.01mol/L的K2CrO4的混合溶液,c(CrO42-)=0.01mol/L,得到c(Ag+)=10-12÷0.01=10-5mol/L,0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依据溶度积计算得到:c(Ag+)=2×10?10÷0.01=2×10-8mol/L,所以先析出氯化银沉淀,故C错误;D、在t℃时,反应Ag2CrO4(s)+2Cl-(aq) 2AgCl(s)+CrO42-(aq)的平衡常数
2AgCl(s)+CrO42-(aq)的平衡常数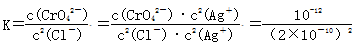 =2.5×107,故D正确,答案选D。
=2.5×107,故D正确,答案选D。
考点:考查了沉淀溶解平衡的分析判断,溶度积常数的计算应用
本题难度:一般
5、填空题 已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=1.5×10-10 ②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示: 
请根据以下信息回答下旬问题:
(1)25℃时,将20mL 0.10 mol/L CH3COOH溶液和20mL 0.10 mol/LHSCN溶液分别与20mL 0.10 mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为下图所示: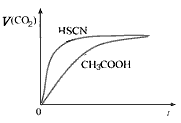
①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是___________________ ,
②反应结束后所得两溶液中,c(CH3COO-)__________c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈__________________ ,列式并说明得出该常数的理由________________ 。
(3)4.0×10-3 mol/LHF溶液与4.0×10-4 mol/LCaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。_____________________________
参考答案:(1)①相同的起始条件,只能是因为两种酸的电离度不同导致溶液中起始反应时H+浓度不同引起反应速率的不同;②<。
(2)Ka=0.4×10-3;HF电离平衡常数Ka= c(H+)·c(F-)/ c(HF),其中c(H+)、 c(F-)、 c(HF)都是电离达到平衡时的浓度,选择中间段图像求解。根据图像:PH=4时,c(H+)=10-4, c(F-)=1.6×10-3、 c(HF)=4.0×10-4。
(3)PH=4.0,则c(H+)=10-4,此时:根据HF电离,产生的c(F-)=1.6×10-3,而溶液中的c(Ca2+)=2.0×10-4。c2(F-)×c(Ca2+)=5.12×10-10, 5.12×10-10大于Kap(CaF2)=1.5×10-10,此时有少量沉淀产生。
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《酯》高频试.. | |