微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某原电池总反应离子方程式为2Fe3++Fe═3Fe2+,能实现该反应的原电池是( )
A.正极为铜,负极为铁,电解质溶液为FeCl3溶液
B.正极为铜,负极为铁,电解质溶液为Fe(NO3)2溶液
C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3
D.正极为银,负极为铁,电解质溶液为CuSO4
参考答案:A、铁的活泼性大于铜,铁作负极,铜作正极,电解质溶液为氯化铁,所以是能实现该反应的原电池,故A正确;
B、不存在自发的氧化还原反应,所以不能实现该反应的原电池,故B错误;
C、锌的活泼性大于铁,锌作负极,铁作正极,电解质溶液为硫酸铁,所以是不能实现该反应的原电池,故C错误;
D、铁的活泼性大于银,铁作负极,银作正极,电解质溶液为硫酸铜,所以是不能实现该反应的原电池,故D错误;
故选A.
本题解析:
本题难度:简单
2、选择题 如下图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是
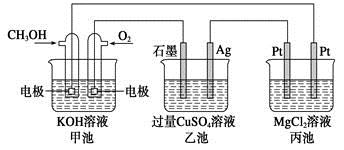
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
参考答案:D
本题解析:甲池为原电池,作为电源,电解乙池、丙池两个电解池。根据原电池的形成条件,通入CH3OH的一极为负极,通入O2的一极为正极,所以石墨、Pt(左)作阳极,Ag、Pt(右)作阴极;B项,负极反应:CH3OH-6e-+8OH-=CO32-+6H2O;C项,应加入CuO;D项,丙池中:MgCl2+2H2OMg(OH)2↓+Cl2↑+H2↑,消耗0.0125 mol O2,转移0.05 mol电子,生成0.025 mol Mg(OH)2,其质量为1.45 g。答案选D。
本题难度:一般
3、简答题 根据以下实验装置和现象填写实验报告(A、B、C、D为四种金属)
| 装置 |

|
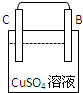
|
现象
B棒有气泡
C棒有Cu析出
A棒附近PH升高
①
②
③
|
四种金属活动性由强到弱的顺序:______
参考答案:①B棒上有气泡发生,说明B棒上发生还原反应生成氢气,则B棒为原电池的正极,A为负极,活泼性A>B,
②C棒有Cu析出,发生还原反应,为原电池的正极,B为负极,活泼性B>C,
③A棒附近PH升高,发生吸氧腐蚀,A棒上生成氢氧根离子,A极上发生还原反应,为原电池的正极,D棒为负极,活泼性D>A,
所以四种金属活动性由强到弱的顺序为D>A>B>C,故答案为:D>A>B>C.
本题解析:
本题难度:一般
4、选择题 人造地球卫星用到的一种高能电池--银锌蓄电池,其电池的电极反应式为:Zn+2OH--2e-=ZnO+H2O,
Ag2O+H2O+2e-==2Ag+2OH-。据此判断氧化银是
[? ]
A.负极,并被氧化
B.正极,并被还原
C.负极,并被还原
D.正极,并被氧化
参考答案:B
本题解析:
本题难度:简单
5、选择题 下列各组金属均有导线相连,并插入对应的液体中,其中不能组成原电池的是
A.Zn ∣H2SO4(稀)∣Fe
B.Cu ∣ AgNO3(aq)∣ Ag
C.Zn ∣ CCl4∣ Cu
D.Fe ∣ H2SO4(稀) ∣ Fe
参考答案:C
本题解析:C中四氯化碳不是电解质溶液,不能构成原电池。
点评:一般来说,形成原电池需满足以下条件:活泼性不同的两个电极、闭合回路、电解质溶液。
本题难度:一般
|