微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质中既能与稀硫酸反应,又能与氢氧化钠溶液反应是
[? ]
(1)NaHCO3?(2)?(NH4)2S?(3)?Al2O3?(4)?Al?(5)?Al?(OH)3
A.(3)?(4)?
B.(3)?(4)?(5)?
C.(1)?(3)?(4)?(5)?
D.全部
参考答案:D
本题解析:
本题难度:一般
2、选择题 某无色溶液中,已知含有H+、Al3+、Mg2+等阳离子,逐渐加入NaOH溶液,则消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系可用下图来表示,则下列关系正确的是(?)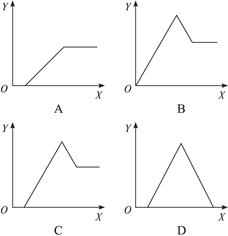
参考答案:C
本题解析:无色溶液中加入氢氧化钠溶液时,OH-首先与H+反应,无沉淀生成,然后再与Al3+、Mg2+作用形成沉淀,沉淀处于最高点时Al3+、Mg2+全部以氢氧化物析出,继续加碱时,由于氢氧化铝具有两性会继续溶解,而氢氧化镁不能溶解,故A、B、D三项均不正确。
本题难度:简单
3、选择题 将15.6 g Na2O2和5.4 g铝粉同时放入一定量的水中,充分反应后得到200 ml溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是
A.标准状况下,反应过程中得到8.96 L的气体
B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C.最终得到7.8 g的沉淀
D.最终得到的溶液中c(Na+)=1.5 mol/L
参考答案:AC
本题解析:15.6gNa2O2和5.4g铝粉的物质的量都是0.2mol,溶于水发生反应2Na2O2+2H2O=4NaOH+O2↑,生成0.4mol氢氧化钠和0.1mol氧气。生成的氢氧化钠又溶解金属铝,发生反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑,其中氢氧化钠是过量的,剩余0.2mol氢氧化钠,生成0.3mol氢气和0.2mol偏铝酸钠,所以标准状况下,反应过程中得到(0.1mol+0.3mol)×22.4L/mol=8.96 L的气体,A正确;氯化氢的物质的量是0.3mol,其中和0.2mo氢氧化钠反应的是0.2mol。另外0.1mol氯化氢和偏铝酸钠反应生成生成0.1mol氢氧化铝白色沉淀,同时还剩余0.1mol偏铝酸钠,所以B不正确,因为溶液中含有偏铝酸钠,C正确。最终得到的溶液中c(Na+)=0.4mol÷0.2L=2.0mol/L,D不正确,答案选AC。
点评:该题是高考中的常见题型,属于综合性试题的考查,侧重对学生解题能力的培养。试题综合性强,贴近高考,旨在培养学生分析、归纳、总结问题的能力。有利于调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力和抽象思维能力。该题的关键是明确反应原理,然后结合题意灵活运用即可。
本题难度:简单
4、选择题 下列有关厨房铝制品的使用中,你认为合理的是( )
A.盛放食醋
B.烧煮开水
C.用金属丝擦洗表面的污垢
D.用碱水洗涤
参考答案:铝既能与酸反应又能与碱反应,故AD项不合理;C项铝制品表面有一层致密的氧化薄膜,可以起到保护作用,若用金属丝擦表面的污垢,会破坏保护膜,不可取,
铝与热水不反应,所以B项正确.
故选B.
本题解析:
本题难度:一般
5、选择题 下列关于金属铝的叙述中,说法不正确的是( )
A.Al是地壳中含量最多的元素
B.Al是比较活泼的金属,在化学反应中容易失去电子,表现还原性
C.Al箔在空气中受热可以熔化,但是不能剧烈燃烧
D.Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al并不滴落
参考答案:A、地壳中含量最多的几种元素是氧、硅、铝、铁等,故含量最多的金属是铝,含量最多的元素是氧元素,故A错误;
B、Al是比较活泼的金属,在化学反应中容易失去电子,表现还原性,故B正确;
C、铝箔在空气中受热可以溶化,铝与氧气反应生成氧化铝为致密的氧化物,阻止反应的进一步发生,则不会剧烈燃烧,故C正确;
D、Al箔在空气中受热可以熔化,由于氧化膜的存在,包在铝的外面,所以熔化的Al并不滴落,故D正确;
本题解析:
本题难度:一般